题目内容
19.下列离子方程式书写正确的是( )| A. | 用Cu片作阳极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+H2↑+2OH- | |
| B. | 用两个铜片作电极电解AgNO3溶液:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$Ag+O2+4H+ | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 用石墨作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ |
分析 A.Cu作电极,阳极上Cu失去电子,阴极上氢离子得到电子;
B.Cu在阳极失去电子,阴极上银离子得到电子;
C.电解生成氢氧化铝、氢气、氯气;
D.电解生成硫酸、Cu和氧气.
解答 解:A.用Cu片作阳极电解饱和食盐水的离子反应为Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,故A错误;
B.用两个铜片作电极电解AgNO3溶液的离子反应为2Ag++Cu$\frac{\underline{\;电解\;}}{\;}$2Ag+Cu2+,故B错误;
C.用石墨作电极电解AlCl3溶液的离子反应为2Al3++6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$3Cl2↑+3H2↑+2Al(OH)3↓,故C错误;
D.用石墨作电极电解CuSO4溶液的离子反应为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握电解原理、电解反应为解答的关键,侧重分析与应用能力的考查,注意离子的放电顺序,题目难度不大.

练习册系列答案
相关题目
4.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该硫酸试剂可以做干燥剂,干燥任何气体 | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 常温下,2.7g Al与足量的稀硫酸反应得到H23.36L | |
| D. | 配制200mL 4.6mol•L-1的稀硫酸需取该硫酸50.0mL |
1.下表是部分短周期元素的原子半径及主要化合价:
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位置是第三周期IA族.
(2)Y的氢化物比Q的氢化物沸点高的原因是NH3的分子间存在氢键.
(3)X或与R按1:1的原子个数比形成化合物甲,甲中存在的化学键有离子键和非极性键(或离子键,共价键;X可与W组成含18e-的化合物乙,则乙的电子式为 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
| 元素代号 | W | R | X | Y | Z | Q |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.110 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2、+4 | -3、+5 |
(1)五种元素中原子半径最大的元素在周期表中位置是第三周期IA族.
(2)Y的氢化物比Q的氢化物沸点高的原因是NH3的分子间存在氢键.
(3)X或与R按1:1的原子个数比形成化合物甲,甲中存在的化学键有离子键和非极性键(或离子键,共价键;X可与W组成含18e-的化合物乙,则乙的电子式为
 ;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
;X可与Z组成一种有恶臭味的气体丙,丙分子中各原子最外层均满足8e-结构,且含有非极性键.1mol丙气体可与2mol氧气完全反应,生成一种气体,且反应前后气体的总体积不变,该生成物能使澄清石灰水变浑浊,请写出丙分子的结构式O=C=C=C=O.
2.用NA表示阿状加德罗常数,下列说法正确的是( )
| A. | 78g Na2O2与足量水反应中电子转移了0.2NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有(不含立体异构)4种 | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |

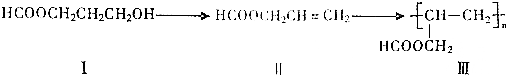
 .
.