题目内容
1. 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均己充满电子.请回答下列问题:(1)Z2+基态核外电子排布式为1s22s22p63s23p63d9.
(2)YX4-的空间构型是正四面体,与YX4-互为等电子体的一种分子为CCl4等(填化学式);HYX4酸性比HYX2强,其原因是HClO4有 3 个非羟基氧,而 HClO2有 1 个非羟基氧.
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为sp2;lmo1RX (W2H3)2分子中含有σ键数目为11NA.
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)]SO4,下列说法正确的是A.
A.[Z(WH3)]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)]SO4组成元素中第一电离能最大的是氧元素
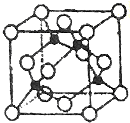
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子).
①该晶体的化学式为CuCl
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于共价(填“离子”、“共价”)化合物.
③已知该晶体的密度为ρg•cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$×1010pm(只写计算式).
分析 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,核外电子排布式为1s22s22p2,则R为C元素;工业上通过分离液态空气获得X单质,结合原子序数可知X为O元素、W为N元素;Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,三元素原子序数之和为6+7+8=21,则Y为Cl元素;Z基态原子的最外能层只有一个电子,其他能层均已充满电子,原子序数大于氯,处于第四周期,核外电子数为2+8+18+1=29,故Z为Cu.
解答 解:周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子,核外电子排布式为1s22s22p2,则R为C元素;工业上通过分离液态空气获得X单质,结合原子序数可知X为O元素、W为N元素;Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,三元素原子序数之和为6+7+8=21,则Y为Cl元素;Z基态原子的最外能层只有一个电子,其他能层均已充满电子,原子序数大于氯,处于第四周期,核外电子数为2+8+18+1=29,故Z为Cu.
(1)Cu2+基态核外电子排布式为:1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)ClO4-中Cl原子孤电子对数=$\frac{7+1-2×4}{2}$=0、价层电子对数=4+0=4,故其空间构型是正四面体,与ClO4-互为等电子体的一种分子含有5个原子、32个价电子,该分子为CCl4等,HClO4有 3 个非羟基氧,而 HClO2有 1 个非羟基氧,HClO4酸性比HClO2强,
故答案为:正四面体;CCl4等;HClO4有 3 个非羟基氧,而 HClO2有 1 个非羟基氧;
(3)结构简式为CO(N2H3)2的化合物中碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子的杂化轨道类型为sp2;
结构简式为O=C(NH-NH2)2,分子中含有11个σ键,1molRX(W2H3)2分子中含有σ键数目为11NA,
故答案为:sp2;11NA;
(4)往CuSO4溶液中通入过量的NH3,可生成[Cu(NH3)4]SO4,
A.[Cu(NH3)4]SO4中配离子与外界硫酸根之间形成离子键,铜离子与氨气分子之间形成配位键,氨气分子与硫酸根中含有极性键,故A正确;
B.在[Cu(NH3)4]2+中Cu2+提供空轨道,NH3给出孤对电子,故B错误;
C.非金属性越强,第一电离能越大,氮元素2p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的,[Cu(NH3)4]SO4组成元素中第一电离能最大的是N元素.
故选:A;
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子).
①晶胞中黑色球数目为4,白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,该晶体的化学式为CuCl,
故答案为:CuCl;
②已知Z和Y的电负性分别为1.9和3.0,二者电负性之差小于1.7,则Y与Z形成的化合物属于共价化合物,
故答案为:共价;
③黑色球与周围的4个白色球相邻,形成正四面体结构,黑色球与晶胞顶点白色球连线处于晶胞体体对角线上,为二者距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,晶胞质量为4×$\frac{64+35.5}{N{\;}_{A}}$g,该晶体的密度为ρg.cm-3,则晶胞棱长为$\root{3}{\frac{4×\frac{64+35.5}{N{\;}_{A}}g}{ρg•cm{\;}^{-3}}}$=$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$cm,故该晶体中Z原子和Y原子之间的最短距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$cm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$×1010 pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×99.5}{ρN{\;}_{A}}}$×1010.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、空间构型与杂化方式判断、等电子体、分子结构与性质、化学键、电负性、晶胞计算等,(5)中原子距离计算为易错点、难点,需要学生具备一定的数学计算能力.

| 元素 | 元素性质或原子的结构 |
| T | 2p轨道能级电子数比s能级电子数多1个 |
| X | L层p能级电子数比s能级电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有3个未成对电子 |
 .写出元素Z的简单气态氢化物的电子式:
.写出元素Z的简单气态氢化物的电子式: .
.(2)写出元素Y的最高价氧化物对应的水化物与KOH反应的化学方程式:KOH+Al(OH)3=KAlO2+2H2O.
(3)T、Y、Z三种元素的单质中化学性质明显不同于其他单质的是Al(填元素符号,下同);元素T与氯化素相比,非金属性较强的是F,下列表述中能证明这一事实的是c(填字母).
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液中不能置换出来
c.氯与T形成化合物中,氯元素呈正价.
| A. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| B. | CH3CH2OH+HBr$\stackrel{△}{→}$C2H5Br+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O | |
| D. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl |

| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应③为取代反应,有机产物是一种烃 | |
| C. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
| A. | HXO | B. | H2XO3 | C. | HXO3 | D. | H2XO4 |

| A. | 该硫酸试剂可以做干燥剂,干燥任何气体 | |
| B. | 稀释该硫酸时,应将蒸馏水沿玻璃棒缓慢注入其中 | |
| C. | 常温下,2.7g Al与足量的稀硫酸反应得到H23.36L | |
| D. | 配制200mL 4.6mol•L-1的稀硫酸需取该硫酸50.0mL |
