题目内容
 在硬质玻璃管中的A,B,C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的三个棉球(如图所示).向左端导入Cl2,在B处加热,可观察到A处棉球呈
在硬质玻璃管中的A,B,C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的三个棉球(如图所示).向左端导入Cl2,在B处加热,可观察到A处棉球呈考点:探究卤素单质间的置换反应,氯气的化学性质
专题:
分析:氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,其中碘遇淀粉溶液变蓝,据此结论然后根据物质的性质分析即可回答.
解答:
解:氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,溴水为橙色,A处棉球呈橙色,B处棉球中生成的碘单质溶液呈黄色,碘单质遇到淀粉变蓝色,所以C处棉球显蓝色,在B处进行加热,由于碘容易升华,故紫色的碘单质在B处升华变为气体,在B、C之间的试管上遇冷后结晶生成紫黑色的碘固体,故答案为:橙;黄;蓝;紫黑;固体;碘易升华.
点评:本题主要考查了卤素单质之间的置换反应,涉及的知识点还有碘的物理性质、碘遇淀粉变蓝等,侧重于基础知识考查,只要熟练掌握原理即可解答.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
下列说法不正确的是( )
| A、生铁不需要特殊处理就有很强的抗腐蚀能力 |
| B、手机中锂离子电池属于二次电池 |
| C、“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物的合理利用 |
| D、以NaClO为有效成分的漂白液可以作为游泳池的消毒剂 |
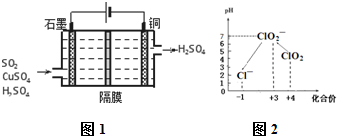

 3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析.