题目内容
14.下列各组物质的性质比较中,正确的是( )| A. | 稳定性:HCl>H2S>H2O | B. | 碱性:NaOH>KOH>Mg(OH)2 | ||
| C. | 酸性:HClO4>HBrO4>HIO4 | D. | 还原性:I-<Br-<Cl- |
分析 A.非金属性越强,对应氢化物的稳定性越强;
B.金属的金属性越强,其对应碱的碱性越强;
C.非金属的非金属性越强,其最高价含氧酸的酸性越强;
D.非金属的非金属性越强,对应阴离子的还原性越弱.
解答 解:A.非金属性O>Cl>S,非金属性越强,氢化物稳定性越强,则氢化物稳定性:H2O>HCl>H2S,故A错误;
B.同一主族中,元素的金属性随着原子序数的增大而增大,所以金属性K>Na,金属的金属性越强,其对应碱的碱性越强,所以碱性强弱:KOH>NaOH,故B错误;
C.同一主族中,元素的非金属性随着原子序数的增大而减小,所以非金属性Cl>Br>I,非金属的非金属性越强,其最高价含氧酸的酸性越强,所以酸性:HClO4>HBrO4>HIO4,故C正确;
D.已知非金属性Cl>Br>I,元素的非金属性越强,则对应的阴离子的还原性越弱,离子的还原性:I->Br->Cl-,故D错误.
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,试题侧重基础知识的考查,有利于培养学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列有关化学用语表示正确的是( )
| A. | 2016年命名的含有173个中子的113号元素:${\;}_{113}^{173}$Nh | |
| B. | 对硝基甲苯的结构简式: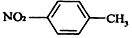 | |
| C. | CSO的电子式: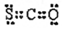 | |
| D. | F-的离子结构示意图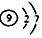 |
5.定量的稀硫酸与过量锌粉反应,为了减慢反应速率但又不影响生成氢气总量的措施是( )
| A. | 加入少量NaOH溶液 | B. | 加入少量的NaHSO4溶液 | ||
| C. | 加入少量的CH3COONa溶液 | D. | 加入少量的CuSO4溶液 |
9.下列有关厨房铝制品的使用中,你认为合理的是( )
| A. | 盛放食醋 | B. | 烧煮开水 | C. | 盛放咸的食物 | D. | 用碱水洗涤 |
19.下列说法正确的是( )
| A. | 已知二元酸H2A在溶液中的电离方程式为:H2A═H++HA- HA-?H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)═c(A2-)+c(HA-)+c(H2A)和c(A2-)═c(H+)-c(OH-) | |
| B. | 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10 | |
| C. | HCN溶液加水稀释的过程中$\frac{c({H}^{+})}{c(C{N}^{-})}$减小 | |
| D. | 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+) |
13.某研究性学习小组设计实验用30mL浓硫酸与10mL无水乙醇共热制备乙烯气体、并测定乙醇转化成乙烯的转化率.已知生成的乙烯气体中含有SO2、CO2、乙醇和乙醚等杂质.有关数据如表:
(1)制备乙烯
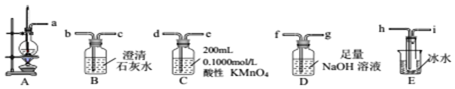
①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.
| 熔点/℃ | 沸点/℃ | 溶解性 | 颜色状态 | 密度g/cm3 | |
| 乙醇 | -114.1 | 78.3 | 与水、有机溶剂互溶 | 无色液体 | 0.79 |
| 乙醚 | -116.2 | 34.5 | 不溶于水,易溶于有机溶剂 | 无色液体 | 0.7135 |

①从A~E中选择必要的装置完成实验,并按气流方向连接的顺序为a→h、i→f、g→d(填仪器接口的字母编号).
②D装置中发生反应的离子方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O实验后,检验D溶液中含有CO32-的实验方案为取少许D溶液于试管中,先滴加足量的双氧水,然后再加入一定量的硫酸,产生能使澄清石灰水浑浊的气体,则证明D溶液中含有CO32-.
③E装置的主要作用是冷凝并收集乙醚.
(2)测定乙烯
反应结束后,用移液管移取C中溶液20mL(不考虑溶液体积变化)于锥形瓶中,先加入约2mL稀硫酸酸化.再用0.1000mol/L的Na2C2O4溶液滴定未反应完的KMnO4.
已知:C2H4$→_{H+}^{KMnO_{4}}$CO2+H2O;C2O42- $→_{H+}^{KMnO_{4}}$CO2+H2O;MnO4-→Mn2+
④以下情况使得测定乙烯的量偏高的是CD
A.在用蒸馏水清洗碱式滴定管后,直接装Na2C2O4标准液
B.锥形瓶清洗干净后残有大量水珠
C.滴定前,滴定管内无气泡,滴定后有气泡
D.读数时,滴定前平视,滴定后俯视
⑤油定终点的现象为溶液由粉红色变成无色,且半分钟内不变色.
⑥已知用去Na2C2O4溶液20.00mL,则乙醇转化成乙烯的转化率为2.94%.

 .
.