题目内容
17.下列反应属于吸热反应的是( )| A. | 碳酸钙分解 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 锌放入稀硫酸中 | D. | 氯化铵晶体与氢氧化钡晶体混合 |
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),八水合氢氧化钡与氯化铵的反应.
解答 解:A.碳酸钙高温下分解属于吸热反应,故A正确;
B.盐酸和氢氧化钠溶液反应为中和反应,是放热反应,故B错误;
C.锌放入稀硫酸属于放热反应,故C错误;
D.氯化铵晶体与氢氧化钡晶体反应,属于吸热反应,故D正确;
故选AD.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应是解题的关键.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
7.图1曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述不正确的是( )


| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
8.下列叙述正确的是( )
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
12.下列有关实验操作设计、现象记录、结论解释都正确的是( )
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 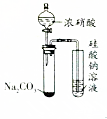 打开分液漏斗 | 右侧试管中出现白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分别加入铁粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的试管中加入0.1mol•LH2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列反应中,属于取代反应的是( )
| A. | CH3-CH3+Cl2→CH3-CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2 H2O | |
| C. | CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +3H2 $→_{△}^{催化剂}$ +3H2 $→_{△}^{催化剂}$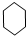 |
9.下列物质属于共价化合物的是( )
| A. | NaBr | B. | N2 | C. | CaCl2 | D. | HCl |
6.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片可防止暴沸 | |
| C. | 加热饱和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
