题目内容
9.下列物质属于共价化合物的是( )| A. | NaBr | B. | N2 | C. | CaCl2 | D. | HCl |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.NaBr中钠离子和溴离子之间只存在离子键,为离子化合物,故A错误;
B.氮气分子中N-N原子之间只存在共价键,为单质,故B错误;
C.氯化钙中钙离子和氯离子之间只存在离子键,为离子化合物,故C错误;
D.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故D正确;
故选D.
点评 本题考查化学键及化合物类型判断,为高频考点,侧重考查对基本概念的理解和掌握,明确离子键、共价键的区别及离子化合物和共价化合物的区别是解本题关键,题目难度不大.

练习册系列答案
相关题目
19.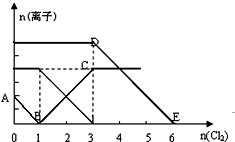 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
20.下列说法错误的是( )
| A. | 某电中性单核粒子含有6个电子、7个中子,该粒子是${\;}_{6}^{13}$C | |
| B. | 在Na+、O2-、Cl、Cl-四种粒子中,半径最大的是Cl-,半径最小的是Na+ | |
| C. | 在离子RO3n-中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是A-x+n+24 | |
| D. | 硫离子的结构示意图为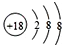 |
17.下列反应属于吸热反应的是( )
| A. | 碳酸钙分解 | B. | 盐酸和氢氧化钠溶液混合 | ||
| C. | 锌放入稀硫酸中 | D. | 氯化铵晶体与氢氧化钡晶体混合 |
4.下列说法正确的是( )
| A. | 所有的烷烃,彼此都是同系物 | |
| B. | 两种化合物的组成元素相同,各元素的质量分数也相同,二者一定具有相同最简式 | |
| C. | 组成元素的质量分数相同的不同化合物互为同分异构体 | |
| D. | 互为同系物的有机物相对分子质量一定相差14的整数倍 |
1.某碳酸钠样品中可能含有硫酸钠、氯化钠等杂质,为确定其所含杂质的具体成分,提出假设和具体实验方案.实验所需玻璃仪器任选,可供药品有:稀硫酸、稀硝酸、稀盐酸、NaOH稀溶液、AgNO3等溶液、BaCl2溶液、Ba(NO3)2溶液及蒸馏水等.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
(1)苏品中可能含有的杂质:
假设1:只含有氯化钠;
假设2:只含有硫酸钠;
假设3:含Na2SO4和NaCl
(2)基于假设,李蕾同学进行了下列实验:取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀.该同学认为样品中含有硫酸钠.你认为李蕾同学的结论是否正确,并简述你的理由.结论正确(填“正确”、“不正确”或“无法确定”);理由是:加入稀盐酸,无明显现象,则一定不是AgNO3、Na2CO3,再加入BaCl2溶液,有白色沉淀产生,则该物质是Na2SO4
(3)若要求只能取一次样品,且实验要求连续进行.则为了验证“假设3”的正确性,陈丹同学设计了如表所示的实验方案,请你在空格中填入相关内容,完善实验方案.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水溶解后,向试管中加入足量稀硝酸 | 有气体产生,说明样品中含有Na2CO3 |
| ② | 向试管中加入足量Ba(NO3)2溶液 | 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4 |
| ③ | 若②操作无沉淀,则向试管中加入0.1mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1mol•L-1AgNO3溶液 | 有沉淀产生,则含NaCl;无沉淀产生,则不含NaCl |
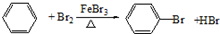 反应类型取代反应.
反应类型取代反应.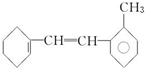 有机物结构简式如下:
有机物结构简式如下: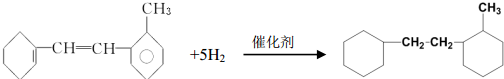 .
.