题目内容
10.铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )| A. | 滴加少量硫酸铜溶液 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 加热 |
分析 加快铁与稀硫酸的反应速率,可通过增大浓度、升高温度、形成原电池反应或者增大反应物接触面积等角度.
解答 解:A.滴加少量CuSO4溶液,置换出Cu,形成原电池,发生电化学反应,反应速率加快,故A不选;
B.不用铁片,改用铁粉,增大反应物接触面积,反应速率加快,故B不选;
C.铁与浓硫酸反应不生成氢气,不能增大生成氢气的速率,故C选;
D.加热,升高温度可加快反应速率,故D不选.
故选C.
点评 本题考查影响反应速率的因素,题目难度不大,本题注意温度、浓度、催化剂等条件对反应速率的影响,本题特别是注意原电池反应原理以及固体表面积对反应速率的影响.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | O2和O3的混合物共16g,其中所含氧原子数为NA | |
| B. | 1.0L 0.1mol/L的AlCl3溶液中含有的铝离子数为0.1NA | |
| C. | 28g乙烯中所含有共用电子对数目为4NA | |
| D. | 1mol金属钠完全转化为Na2O2所转移的电子数目为2NA |
1.用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
18.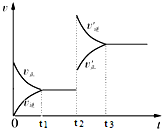 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
 向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)?2HI(g)△H<0,当达到平衡后,t2时刻改变反应的某一条件(混合气体总物质的量不变),速率变化如图所示,则下列说法正确的是( )| A. | 重新达到平衡后,平衡常数K增大 | B. | t2时刻改变的条件可以是升高温度 | ||
| C. | I2(g)转化率增大,HI平衡浓度增大 | D. | t2时刻改变是可以增大压强 |
5.下列各组化合物的性质比较,不正确的是( )
| A. | 稳定性:PH3>H2S>HCl | B. | 酸性:HClO4>HBrO4>HIO4 | ||
| C. | 非金属性:F>O>S | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
2.常温下,下列物质的水溶液,因为水解使溶液的pH<7的是( )
| A. | Na2S | B. | H2SO3 | C. | Al(SO4)3 | D. | NaHSO4 |
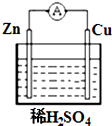 如图所示,在铜锌原电池中,以稀硫酸为电解质溶液:
如图所示,在铜锌原电池中,以稀硫酸为电解质溶液: