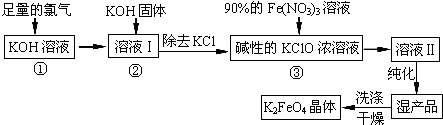
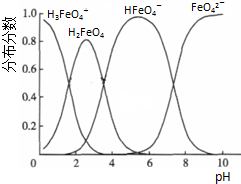
题目内容
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | O2和O3的混合物共16g,其中所含氧原子数为NA | |
| B. | 1.0L 0.1mol/L的AlCl3溶液中含有的铝离子数为0.1NA | |
| C. | 28g乙烯中所含有共用电子对数目为4NA | |
| D. | 1mol金属钠完全转化为Na2O2所转移的电子数目为2NA |
分析 A、氧气和臭氧均由氧原子构成;
B、铝离子是弱碱阳离子,在溶液中会水解;
C、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
D、根据反应后钠元素为+1价来分析.
解答 解:A、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,即NA个,故A正确;
B、铝离子是弱碱阳离子,在溶液中会水解,故溶液中铝离子的个数小于0.1NA个,故B错误;
C、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,即6NA对,故C错误;
D、由于反应后钠元素为+1价,故1mol金属钠失去1mol电子,即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
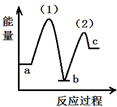
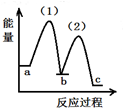
11.根据相应的图象,判断下列相关说法正确的是( )


| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
8.下列离子方程式书写正确的是( )
| A. | 醋酸除水垢:2CH3COO-+2H++CaCO3═(CH3COO)2Ca+CO2↑+H2O | |
| B. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 稀硫酸除铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| D. | 酸性条件下KIO3与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- |
15.二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g),反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
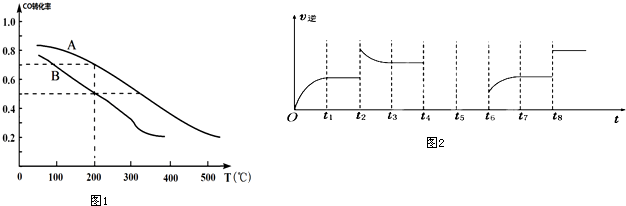
(4)反应Ⅲ逆反应速率与时间的关系如2图所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{[C{H}_{3}OC{H}_{3}][{H}_{2}O]}{[C{H}_{3}OH]}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g),反应发生,所以能提高CH3OCH3的产率,原因是此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.

(4)反应Ⅲ逆反应速率与时间的关系如2图所示:
①试判断t2时改变的条件是增大生成物C浓度或升高温度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
5.用化学方法不能实现的是( )
| A. | 生成一种新分子 | B. | 生成一种新离子 | ||
| C. | 生成一种新同位素 | D. | 生成一种新单质 |
10.铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )
| A. | 滴加少量硫酸铜溶液 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 加热 |