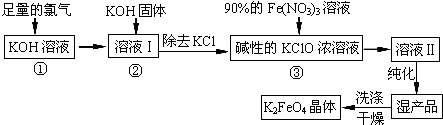
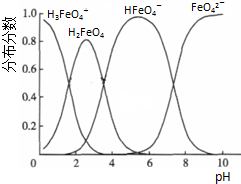
题目内容
2.常温下,下列物质的水溶液,因为水解使溶液的pH<7的是( )| A. | Na2S | B. | H2SO3 | C. | Al(SO4)3 | D. | NaHSO4 |
分析 只有盐才可能水解,而盐水解使溶液的pH<7,即盐水解显酸性,必须为强酸弱碱盐,据此分析.
解答 解:只有盐才可能水解,根据盐类的水解规律“谁强显谁性”可知,要水解显酸性,需要为强酸弱碱盐.
A、Na2S为强碱弱酸盐,水解显碱性,故A错误;
B、H2SO3是弱酸不是盐,不能水解,故B错误;
C、Al2(SO4)3是强酸弱碱盐,水解显酸性,故C正确;
D、NaHSO4是强碱强酸盐,在溶液中不能水解,其显酸性是由于其能电离出氢离子,故D错误.
故选C.
点评 本题考查盐类的水解,根据盐类水解的原理进行判断即可,本题难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.某化学反应在所有温度下都能自发进行,下列对该反应的叙述正确的是( )
| A. | 放热反应,熵增加 | B. | 放热反应,熵减小 | C. | 吸热反应,熵增加 | D. | 吸热反应,熵减小 |
10.铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )
| A. | 滴加少量硫酸铜溶液 | B. | 不用铁片,改用铁粉 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 加热 |
7.下列说法正确的是( )
| A. | 0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 | |
| B. | pH=2与pH=1的硝酸中c(H+)之比为1:10 | |
| C. | 在50℃时,pH=2的硫酸与pH=12的NaOH溶液等体积混合后,溶液的pH=7 | |
| D. | pH均等于5的HCl溶液和NH4Cl溶液中,水的电离程度相等 |
14.不属于化学科学研究的项目是( )
| A. | 研究质子、中子的结构 | B. | 寻找新的性能良好的材料 | ||
| C. | 开发新能源 | D. | 治理环境污染 |
12.下列说法正确的是( )
| A. | 0.1mol•L-1的NaCl溶液表示的是1L溶剂中溶解0.1mol NaCl的溶液 | |
| B. | 将0.1mol氧化钠溶于水并配成1L溶液,则溶液的物质的量浓度为0.1mol•L-1 | |
| C. | 物质的量浓度和溶质质量分数均是表示溶液组成的物理量 | |
| D. | 0.1mol•L-1的CaCl2溶液中c(Cl-)也为0.1mol•L-1 |