题目内容
7.N2O5是一种新型硝化剂,在一定温度下向密闭容器中通入N2O5气体,发生如下反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.部分实验数据见表:| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
分析 A.依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算平衡浓度结合平衡常数概念计算平衡常数,计算转化率;
C.将容器的体积压缩到原来的$\frac{1}{2}$,各物质的浓度先变为原来的2倍,而加压平衡左移;
D.该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡常数增大.
解答 解:A.依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L=1.48mol/L,分解速率=$\frac{1.48mol/L}{500s}$=2.96×10-3 mol/(L•s),故A正确;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,平衡常数K=$\frac{[{O}_{2}]•[N{O}_{2}]^{4}}{[{N}_{2}{O}_{5}]^{2}}$=125,转化率为$\frac{5-2.5}{5}$×100%=50%,故B错误;
C.T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,达平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,各物质的浓度先变为原来的2倍,而加压平衡左移,则c(N2O5)>5.00 mol•L-1,故C错误;
D.该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡常数增大,故D正确;
故选BC.
点评 本题考查较为综合,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的空啊差,题目涉及化学反应速率计算、化学平衡有关计算、化学平衡影响因素、平衡常数等,难度中等.

 黄冈创优卷系列答案
黄冈创优卷系列答案| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
| A. | 改变外界条件不能改变化学反应的限度 | |
| B. | 当某反应在一定条件下达到反应限度时即达到化学平衡状态 | |
| C. | 浓度、压强、催化剂、温度等均能改变活化分子的百分数 | |
| D. | 能自发进行的反应其速率都很大 |
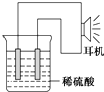 乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白: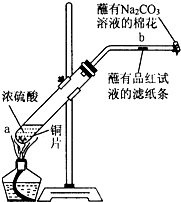 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题: