题目内容
17.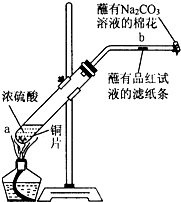 某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:
某化学实验小组为确认铜与浓硫酸反应的产物,设计如图实验装置.在一支试管中放入一块很小的铜片,再加入适量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中,塞紧试管口,在玻璃导管口处放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.回答下列问题:(1)写出a处反应的化学方程式Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)试管中的反应进行一段时间后,b处滤纸条的变化为滤纸条褪色,据此可以确认产物中一定有SO2(填化学式).
(3)反应结束后在试管底部常可见到一些白色固体,该固体可能是CuSO4(填化学式),将试管上层液体倒去,再向试管中慢慢加入少量水,振荡,静置,观察溶液的颜色变化.这一步操作的目的是要证实Cu与浓H2SO4反应生成了CuSO4.
(4)玻璃导管口处放一团蘸有Na2CO3溶液的棉花所起的作用是吸收二氧化硫,防止污染,反应的化学方程式为Na2CO3+SO2=Na2SO3+CO2.
分析 (1)铜和热的浓硫酸反应生成二氧化硫、硫酸铜和水;
(2)二氧化硫具有漂白性;二氧化硫与品红溶液反应生成不稳定的无色物质;
(3)铜和浓硫酸加热反应生成硫酸铜为白色固体,硫酸铜溶液的颜色为蓝色;
(4)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水.
解答 解:(1)铜和浓硫酸在加热条件下能发生反应,浓硫酸具有强氧化性,被铜还原为二氧化硫,所以产物有生成的硫酸铜、二氧化硫和水,书写化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)铜和热的浓硫酸反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,二氧化硫与品红溶液反应生成不稳定的无色物质,b处滤纸条的变化为滤纸条褪色,据此可以确认产物中一定有SO2,
故答案为:滤纸条褪色; SO2;
(3)铜和热的浓硫酸反应,溶液中出现白色固体,生成的产物为硫酸铜,待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,振荡,静置,观察溶液的颜色变化.溶液的颜色为蓝色,这一步操作的目的是要证实Cu与浓H2SO4反应生成了CuSO4,
故答案为:白; CuSO4;Cu与浓H2SO4反应生成了CuSO4;
(4)二氧化硫有毒,所以不能直接排空,二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以试管Ⅱ管口塞一团浸有NaOH溶液的棉花的作用是吸收未反应的SO2气体,发生反应的化学方程式为Na2CO3+SO2═Na2SO3+CO2↑;
故答案为:吸收二氧化硫,防止污染; Na2CO3+SO2═Na2SO3+CO2↑.
点评 本题考查了浓硫酸、二氧化硫的性质,题目难度不大,注意二氧化硫的漂白性是暂时的,加热时会恢复原来的颜色.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
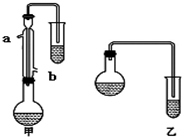 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(2)实验中浓硫酸的作用是催化剂、吸水剂.
(3)反应物CH3OH应过量,理由是反应物CH3OH过量,使平衡向右移动,有利于提高苯甲酸的转化率.
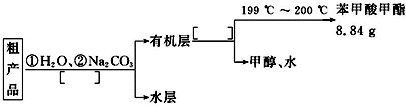
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称.
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.
下列结论正确的是( )
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
①CO(g)+2H2(g)═CH3OH(g)
②CaCO3(s)+2HCl(aq)═CaCl2(aq)+CO2(g)+H2O(l)
③C(s)+O2(g)═CO2(g)
④2HgO(s)═2Hg(l)+O2(g)
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=571.6kJ•mol-1(反应热) |
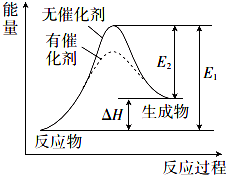 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |