题目内容
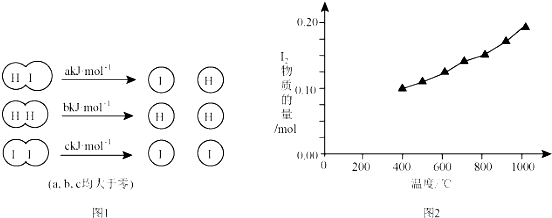
8. 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)(1)先把混合物分离得到(C2H4O)n:将混合物放入分液漏斗中,静置,分离操作名称为分液.
(2)证明已有部分乙醛被氧化的实验操作和现象是取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化.
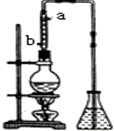
(3)提取乙醛的装置如图所示:烧瓶中放的是(C2H4O)n和6mol/LH2SO4的混合液,锥形瓶中是蒸馏水.加热至混合液沸腾,(C2H4O)n缓慢分解,生成的气体导入锥形瓶的水中.
①冷凝管的目的是使加合物冷凝回流到烧瓶内,冷凝水的进口是b(填“a”或“b”).
②锥形瓶内导管口出现气泡,从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛具有易溶于水的性质,当观察到导气管中气流很小时,必要的操作是及时撤去导管,目的是防止倒吸.
分析 本题是探究乙醛长期放置出现分层现象的原因,对混合物分离时涉及分液及蒸馏操作,考查了操作要点,如分层是用分液,混溶时用蒸馏,蒸馏时需要用冷凝管冷却,冷却水的流向为低进高出等,另外还考查了醛的化学性质如发生银镜反应及探究加合物的结构;
(1)久置的乙醛溶液会产生分层现象,因此分离时可选择分液漏斗通过分液进行操作;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性;
(3)①蒸馏操作时会有部分加合物随温度的升高再挥发,如果不使用冷凝管使之液化后重新流入烧瓶内,会使得到的乙醛不纯,另外原料利用率也低;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明气体溶于溶液,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,据此答题.
解答 解:(1)先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出,
故答案为:分液漏斗;分液;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性,具体操作为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化,
故答案为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化;
(3)①利用冷凝管使挥发出的加合物液化后重新流入到烧瓶内,这样既保证了乙醛的纯度,也提高了原料的利用率,冷凝时冷却水的方向与蒸汽的流向相反,应该是低时高出,
故答案为:使加合物冷凝回流到烧瓶内;b;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛易溶于水,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,
故答案为:易溶于水;及时撤去导管;防止倒吸.
点评 本题考查了乙醛的化学性质,综合性较强,涉及混合物的分离和提纯、实验仪器、乙醛的性质等,难度中等.


下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |

| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 中和热测定实验中把盐酸分多次加入氢氧化钠溶液中 | |
| D. | 酸碱中和滴定实验中锥形瓶需要用待测液润洗 |
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 | B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2 | ||
| C. | HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3 | D. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4 |
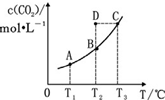 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )| A. | 反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在 T2时,若反应处于状态 D,则有 v 正<v 逆 | |
| C. | 平衡状态 A 与 C 相比,平衡状态 A 的 c(CO)小 | |
| D. | 若 T1、T2时的平衡常数分别为 K1、K2,则 K1<K2 |
| A. | 冰毒 | B. | 盘尼西林 | C. | 海洛因 | D. | 吗啡 |