题目内容
5.部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.92g,经如图处理:
下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |
分析 硫酸足量,由氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,以此来解答.
解答 解:A.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+,故A错误;
B.由以上分析可知样品中含有3.2gCu元素,铁元素的物质的量为0.04mol,质量为0.04mol×56g/mol=2.24g,则氧元素的质量为5.92g-3.2g-2.24g=0.48g,则该样品中Cu、O元素的质量比为3.2:0.48,故B错误;
C.最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量$\frac{0.48g}{16g/mol}$=0.03mol,它结合氢离子0.06mol,所以硫酸中有0.08-0.06=0.02molH+生成氢气,即生成0.01mol氢气,标况体积为224ml,故C错误;
D.铁元素的物质的量为0.04mol,铁与过量稀硫酸反应生成硫酸亚铁,则反应消耗硫酸的物质的量为0.04mol,故D正确.
故选D.
点评 本题考查金属及化合物的性质、混合物分离提纯综合应用等,为高频考点,把握物质的性质及氧化还原反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 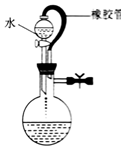 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 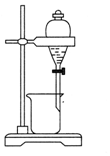 分离酒精和水 | D. | 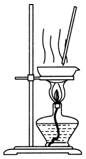 蒸干NH4Cl溶液制NH4Cl固体 |
| A. | 放热的反应发生时不必加热 | |
| B. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应在常温下一定很容易发生 |
| A. | 75mL 2mol•L-1氯化镁溶液 | B. | 150mLl 1 mol•L-1氯化钠溶液 | ||
| C. | 50mL3mol•L-1氯化钾溶液 | D. | 50mL 1 mol•L-1氯化铁溶液 |
| A. | SiO2是酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| B. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 | |
| C. | O3和O2为同种元素组成的单质,所以O3和O2互为同位素 | |
| D. | Na2O和Na2O2组成元素相同,与H2O的反应产物也相同 |
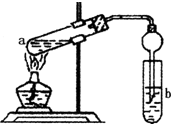 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.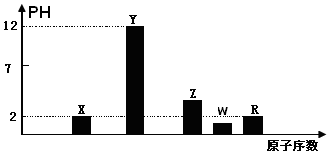


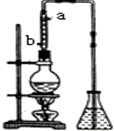 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$n(C2H4O)