题目内容
6.某元素X的碳酸氢盐在高温下完全分解的产物都是氧化物,现取3.24g这种碳酸氢盐高温完全分解后得1.12g固体,又知X的原子核里有20个中子.(1)通过计算确定X的相对原子量(可能用到的相对原子质量:H-1 C-12 O-16)
(2)通过计算确定X是什么元素?
(3)写出X在周期表位于第四周期第ⅡA族.
分析 由题意可知反应的相关方程式为X(HCO3)2$\frac{\underline{\;高温\;}}{\;}$XO+CO2↑+H2O,根据质量变化关系结合方程式可计算X的元素种类.
解答 解:(1)设X的相对原子质量为M,则
X(HCO3)2$\frac{\underline{\;高温\;}}{\;}$XO+2CO2↑+H2O
(M+122)(M+16)
3.24 1.12
则$\frac{(M+122)}{(M+16)}$=$\frac{3.24}{1.12}$,
M=40,
又知X的原子核里有20个中子,则质子数为40-20=20,为Ca元素,位于周期表第四周期ⅡA族,
答:(1)X的相对原子量是40;
(2)X是钙元素;
(3)X位于第四周期第ⅡA族.
点评 本题考查元素的推断,题目难度不大,本题侧重点从质量变化的角度计算元素的相对原子质量,进而推断元素的种类.

练习册系列答案
相关题目
16.如图所示为立方烷(cunane)的球棍模型,下列有关说法不正确的是( )
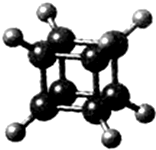

| A. | 它在核磁共振氢谱中只出现一个峰 | |
| B. | 它二氯代物有三种同分异构体 | |
| C. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 | |
| D. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
17.下列实验操作或原理中,正确的是( )
| A. |  定容 | B. |  稀释浓硫酸 | C. |  排水法收集NO | D. |  实验室制氨气 |
14.用价层电子对互斥理论预测SO2和NO3-的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
1.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol/L.
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大.
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.02 | 20.00 | 18.80 | 19.98 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大.
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案用pH计(或精密pH试纸)测定相同浓度的醋酸在几种不同温度时的pH.
11.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的碳原子( )
| A. | 核外有13个电子,核内有13个质子 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
18.元素周期表中有些元素存在对角线相似现象,如Mg与Li;Si与B;Be与Al等元素性质相似.已知,电解熔融LiCl可得Li和Cl2.若用已潮解的LiCl蒸干并加强热至熔融,再用惰性电极电解,生成金属锂和一种气体,该气体是( )
| A. | H2 | B. | O2 | C. | Cl2 | D. | 产生于阴极区 |
15.由石英砂(主要含SiO2)制取高纯硅的工业流程如下:下列说法不正确的是( )

| A. | 反应①③均属于置换反应 | |
| B. | 反应①中氧化产物和还原产物的质量比为1:2 | |
| C. | 该流程中反应①③的还原剂不能互换使用 | |
| D. | 该流程是实现半导体工业“从沙滩到用户”的基础 |
16.下列各组元素中,按最高正化合价递增顺序排列的是( )
①C、N、F ②Na、Mg、Al ③F、Cl、Br ④P、S、Cl.
①C、N、F ②Na、Mg、Al ③F、Cl、Br ④P、S、Cl.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |