题目内容
3.向氯化铁溶液中加入ag铜粉,完全溶解后再加入b g铁粉,充分反应后过滤得到滤液和固体c g.下列说法正确的是( )| A. | 若a>c,则滤液中可能含三种金属离子,且b可能小于c | |
| B. | 若a>c,则c g固体中只含一种金属,且b可能大于c | |
| C. | 若a<c,则c g固体含两种金属,且b可能与c相等 | |
| D. | 若a=c,则滤液中可能含两种金属离子,且b可能小于c |
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向氯化铁溶液中加入ag铜粉,反应反应为2FeCl3+Cu═2FeCl2+CuCl2;完全溶解后再加入b g铁粉,充分反应后过滤得到滤液和固体c g,可能发生反应为2FeCl3+Fe═3FeCl2、CuCl2+Fe═FeCl2+Cu,考虑氧化性Fe3+>Cu2+,则先发生2FeCl3+Fe═3FeCl2反应,根据发生的反应分析.
解答 解:发生的化学反应有三个,化学方程式如下:2FeCl3+Cu═2FeCl2+CuCl2;CuCl2+Fe═FeCl2+Cu;2FeCl3+Fe═3FeCl2,
A.若a>c,说明此时溶液中还有部分铜未完全置换出来,即加入的铁是不足量的,则固体c只含有Cu,由于先发生2FeCl3+Fe═3FeCl2反应,则滤液中不含有Fe3+,只含有Fe2+和Cu2+两种金属离子,当加入铁粉很少量时可能存在b小于c的情况,故A错误;
B.若a>c,说明此时溶液中还有部分铜未完全置换出来,即加入的铁是不足量的,则固体c只含有Cu,考虑先发生2FeCl3+Fe═3FeCl2反应,若氯化铁大量剩余,则存在b大于c的情况,故B正确;
C.若a<c,加入的铁是过量的,溶液中只有Fe2+,c g固体中含两种金属Fe、Cu,由方程式CuCl2+Fe═FeCl2+Cu可知,56gFe可以置换64gCu,如氯化铁过量,则会消耗部分铁粉,因此b可能与c相等,故C正确;
D.若a=c,加入的铁恰好把铜离子完全置换出来,溶液中只有Fe2+,故D错误.
故选:BC.
点评 本题考查了Fe、Cu及其化合物之间的反应,题目难度不大,注意把握Fe与铜离子、铁离子之间的反应,侧重于考查学生的分析判断能力.

练习册系列答案
相关题目
14.用价层电子对互斥理论预测SO2和NO3-的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
11.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C表示的碳原子( )
| A. | 核外有13个电子,核内有13个质子 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
18.元素周期表中有些元素存在对角线相似现象,如Mg与Li;Si与B;Be与Al等元素性质相似.已知,电解熔融LiCl可得Li和Cl2.若用已潮解的LiCl蒸干并加强热至熔融,再用惰性电极电解,生成金属锂和一种气体,该气体是( )
| A. | H2 | B. | O2 | C. | Cl2 | D. | 产生于阴极区 |
8.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常温下,0.1molH2O2中含有极性共价键的数目为0.1NA | |
| B. | 电解饱和食盐水时,当阴极产生22.4LH2时,电路中转移的电子数为2NA | |
| C. | 100mL12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
15.由石英砂(主要含SiO2)制取高纯硅的工业流程如下:下列说法不正确的是( )

| A. | 反应①③均属于置换反应 | |
| B. | 反应①中氧化产物和还原产物的质量比为1:2 | |
| C. | 该流程中反应①③的还原剂不能互换使用 | |
| D. | 该流程是实现半导体工业“从沙滩到用户”的基础 |
12.元素X和Y的原子序数都小于18,两者能组成化合物XY3.已知X的原子序数为n,则Y 的原子序数不可能是( )
| A. | n+3 | B. | n+4 | C. | n-6 | D. | n-8 |
13.图是土豆电池的示意图.土豆电池工作时,下列有关说法正确的是( )
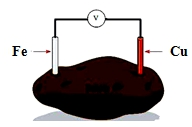

| A. | Fe用作正极 | B. | Cu片质量减少 | ||
| C. | 电子由Fe并经导线流向Cu片 | D. | 实现了电能向化学能的转化 |