题目内容
15.将2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+xD(g),2min后达到平衡时,A的转化率为50%,测得v(D)=0.25mol/(L•min).下列推断正确的是( )| A. | v(C)=0.5mol/(L•min) | |
| B. | x=3 | |
| C. | B的转化率为25% | |
| D. | 若使用催化剂可以缩短达到平衡的时间,但A转化率不变 |
分析 2s后A的转化率为50%,可知转化的A为2mol×50%=1mol,由反应可知生成C为1mol,v(C)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,v(D)=0.25mol•L-1•s-1,由速率之比等于化学计量数之比可知,x=2,则
2A(g)+3B(g)?2C(g)+2D(g),
开始 2 2 0 0
转化 1 1.5 1 1
2s 1 0.5 1 1
以此解答该题.
解答 解:2s后A的转化率为50%,可知转化的A为2mol×50%=1mol,由反应可知生成C为1mol,v(C)=$\frac{\frac{1mol}{2L}}{2s}$=0.25mol•L-1•s-1,v(D)=0.25mol•L-1•s-1,由速率之比等于化学计量数之比可知,x=2,则
2A(g)+3B(g)?2C(g)+2D(g),
开始 2 2 0 0
转化 1 1.5 1 1
2s 1 0.5 1 1
A.由上述分析可知,v(C)=0.25mol•L-1•s-1,故A错误;
B.由上述分析可知,z=2,故B错误;
C.B的转化率为$\frac{1.5}{2}$×100%=75%,故C错误;
D.催化剂降低反应的活化能,同等程度改变反应速率,平衡不移动,故D正确.
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意反应中物质的量的关系,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
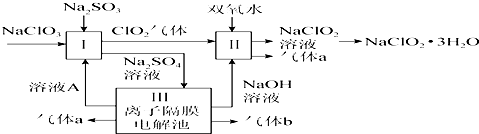
己知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如图1所示:

(1)①上述氧化过程中,发生反应的离子方程式是2Fe3++3ClO-+10OH-=2FeO42-+3C1-+5H2O,在实际生产中一般控制反应温度30℃以下,其原因是防止生成的Na2FeO4发生分解.
②沉淀过程中加入浓KOH溶液可析出高铁酸钾(K2FeO4 ),这说明该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③在提纯K2FeO4中采用重结晶、洗涤、低温烘干的方法,沉淀洗涤方法是将沉淀置于漏斗中,让蒸馏水浸没沉淀,使水自然流下,重复操作2-3次.
④某温度下,将C12通入NaOH溶液中,反应后得到NaCl,NaC1O,NaClO3的混合溶液,经测定ClO-与C1O3-离子的物质的量之比是1:2,则C12与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为11:3.
(2)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图2所示:阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,其中可循环使用的物质是NaOH溶液.
(3)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.
己知:25℃时,几种酸的电离平衡常数如表所示.
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
①NaHSO3②HNO3③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如图3所示.其中符合曲线Ⅱ的溶液为①③.
相关化合物的物理常数
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
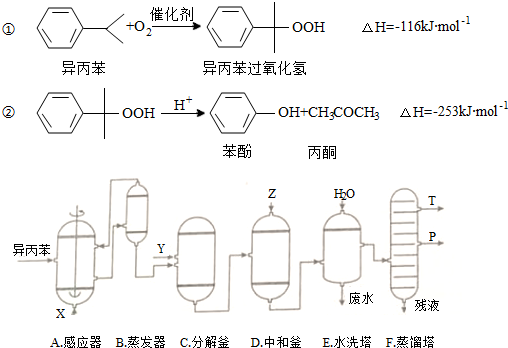
(1)在反应器A中通入的X是氧气或空气;
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂;
(4)中和釜D中加入的Z最适宜的是c(填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(5)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚;
(6)用该方法合成苯酚和丙酮的优点是原子利用率高.
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成 分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
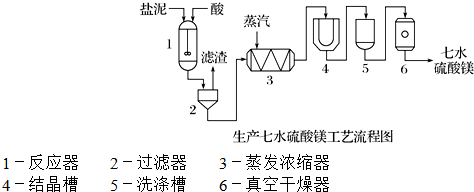
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;.
装置2中滤渣的主要成分为CaSO4、BaSO4等其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
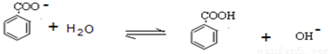 .
.