题目内容
6.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)?2HI(g)已知H2和I2的起始浓度均为0.1mol•L-1时,达平衡时HI的浓度为0.16mol•L-1.若H2和I2的起始浓度均变为0.02mol•L-1,则平衡时HI的浓度(mol•L-1)是( )| A. | 0.08 | B. | 0.04 | C. | 0.032 | D. | 0.036 |
分析 先根据题中所给信息,求出化学平衡常数,温度一定,化学平衡常数不变,再次利用平衡常数求出平衡式H2的浓度.
解答 解:H2(g)+I2(g) 2HI(g)
2HI(g)
起始浓度0.10mol•L-1 0.10mol•L-1 0
反应浓度0.08mol•L-1 0.08mol•L-1 0.16mol•L-1
平衡浓度0.02mol•L-1 0.02mol•L-1 0.16mol•L-1
化学平衡常数K=$\frac{\;C2(HI)}{C(H2)C(I2\;)}$=$\frac{0.16mol•L-10.16mol•L-1}{0.02mol•L-10.02mol•L-1}$=64
当H2和I2的起始浓度均变为0.020mol•L-1时,设则平衡时H2的浓度为x(mol•L-1),
则氢气的反应浓度为( 0.020-x)mol•L-1.
H2(g)+I2(g) 2HI(g)
2HI(g)
起始浓度 0.0020mol•L-1 0.20mol•L-1 0
反应浓度 ( 0.020-x)mol•L-1 ( 0.020-x)mol•L-1 2(0.020-x)mol•L-1
平衡浓度 x x 2(0.020-x)mol•L-1
化学平衡常数K=$\frac{(2×(0.02-x))^{2}}{{x}^{2}}$=64
x=0.004 mol•L-1
则平衡时HI的浓度(mol•L-1)是2(0.020-x)mol•L-1=0.032mol•L-1,
故选C.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析、计算能量的考查,注意温度一定,化学平衡常数不变是解决本题的关键.化学平衡常数K只受温度影响,与反应物或生成物的浓度变化无关.

| A. | 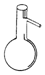 蒸馏烧瓶 | B. |  分液漏斗 | C. | 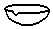 蒸发皿 | D. | 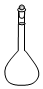 溶量瓶 |
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
(1)实验目的:研究同主族元素性质递变规律.
(2)实验用品:试剂:氯水,溴水,NaBr溶液,KI溶液,CCl4溶液仪器:①试管,②胶头滴管.
(3)此实验的结论为氧化性的强弱顺序为:Cl2>Br2>I2.
(4)氯、溴、碘最高价氧化物对应的水化物酸性强弱(用分子式表示):HClO4>HBrO4>HIO4.
(5)氟、氯、溴、碘气态氢化物稳定性大小顺序(用分子式表示):HF>HCl>HBr>HI.
(6)该同学又做了另外一个实验,向新制得的Na2S溶液中滴加新制的氯水.该实验现象为生成淡黄色沉淀.此反应的离子方程式Cl2+S2-=S↓+2Cl-.此实验的结论为氧化性Cl2>S.
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
| A. | 该温度下,化学平衡常数K=0.1 | |
| B. | H2S的平衡转化率为20% | |
| C. | 增大CO浓度,平衡正向移动,可以提高CO的转化率 | |
| D. | 升高温度,H2S浓度增加,表明该反应正方向是吸热反应 |
| A. | v(C)=0.5mol/(L•min) | |
| B. | x=3 | |
| C. | B的转化率为25% | |
| D. | 若使用催化剂可以缩短达到平衡的时间,但A转化率不变 |
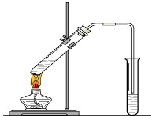 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: