题目内容
4.(1)氯碱工业是利用电解食盐水生产氯气、烧碱、氢气为基础的工业体系.(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,下列加入顺序合理的是D.
A.碳酸钠、氢氧化钠、氯化钡 B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡 D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”.某工厂的盐泥组成如下:
| 成 分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
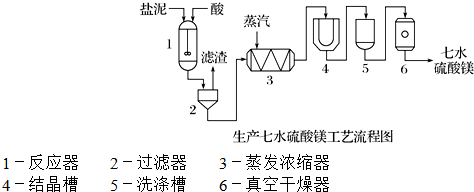
装置1中加入的酸应选用硫酸,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右.持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4.其中碳酸钙可以转化为硫酸钙的原因是使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;.
装置2中滤渣的主要成分为CaSO4、BaSO4等其它不溶物质.
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是NaCl.
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水.
分析 (1)电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,反应物为氯化钠、水;
(2)除去Ca2+,可加入碳酸钠溶液,生成碳酸钙沉淀,除去Mg2+,可加入氢氧化钠溶液,生成氢氧化镁沉淀,除去硫酸根离子加入过量氯化钡溶液生成硫酸钡沉淀,加碳酸钠要放在加氯化钡之后,可以同时除去过量的钡离子;
(3)盐泥酸洗转化为硫酸镁、CaSO4、BaSO4,过滤将CaSO4、BaSO4、其它不溶物质除掉,溶液中剩余硫酸镁和氯化钠.蒸发结晶得到氯化钠,冷却结晶得到硫酸镁.
解答 解:(1)电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,总反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,氯碱工业是利用电解食盐水生产氯气、烧碱、氢气为基础的工业体系,
故答案为:氯气、烧碱、氢气;
(2)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项D符合,故答案为:D.
(3)生产MgSO4•7H2O,应加入硫酸,搅拌过程中CO2不断逸出,平衡向右移动,搅拌过程中CO2不断逸出,使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;CaSO4、BaSO4不溶于硫酸,过滤得到不溶于硫酸的物质,装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是为氯化钠装置6(真空干燥器)干燥七水硫酸镁晶体的理由是防止失去结晶水,
故答案为:硫酸;使平衡CaCO3+H2SO4?CaSO4+H2CO3(H2O+CO2↑)不断向右移动;CaSO4、BaSO4、其它不溶物质;NaCl;防止失去结晶水.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意流程中发生的反应,题目难度中等.

| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
| A. | v(C)=0.5mol/(L•min) | |
| B. | x=3 | |
| C. | B的转化率为25% | |
| D. | 若使用催化剂可以缩短达到平衡的时间,但A转化率不变 |
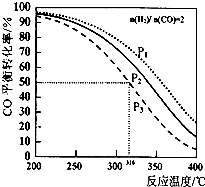 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
| A. | 铁粉作袋装食品的抗氧化剂 | B. | 二氧化硫作纸浆的漂白剂 | ||
| C. | 氢氟酸作普通玻璃的刻蚀剂 | D. | 有机溶剂作食用油的萃取剂 |
| 实验编号 | 反应条件 | 时间 | NO/mol | Cl2/mol | NOCl/mol |
| 实验① | T、恒容 | 初始 | 0.2 | 0.1 | 0 |
| 10 min | 0.05 | 0.025 | |||
| 12 min | 0.15 | ||||
| 实验② | T、恒压 | 初始 | 0.2 | 0.1 | 0 |
| A. | 实验①中,0~10min内,v(NOCl)=7.5×10-3 mol•L-1•min-1 | |
| B. | 平衡时若升高温度,达到新平衡时K=400,则该反应△H>0 | |
| C. | 平衡时实验②比实验①的Cl2转化率大 | |
| D. | 若实验①起始只充入0.4molNOCl,则平衡时NOCl浓度大于0.15mol•L-1 |
