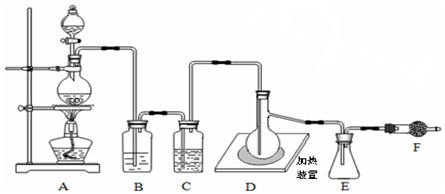
题目内容
3.实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下: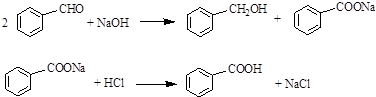
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃).
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
③石蜡油沸点高于250℃
④苯甲醇沸点为205.3℃
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解,稍冷,加入10mL苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行,加热回流约40min;
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.然后用乙醚萃取三次,每次10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③;
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞;将锥形瓶中溶液转入图3所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A;
④将实验步骤②中保留待用的水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,抽滤,得到粗产品,然后提纯得产品B.
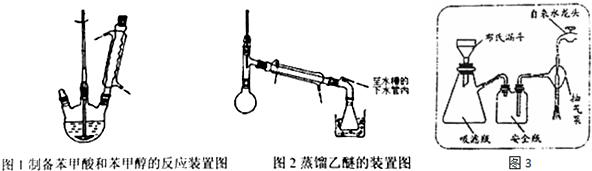
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需分液漏斗(仪器名称).
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去未反应完的苯甲醛,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸,醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因
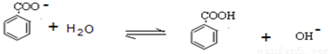 .
.(3)步骤③中无水硫酸镁的作用是吸收水分,锥形瓶上要加塞的原因是防止乙醚挥发与空气混合,发生爆炸,产品A为苯甲醇.
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为水浴加热;蒸馏得产品A的加热方式是石蜡油油浴加热.
(5)步骤④中提纯产品B时所用到的实验方法为重结晶.
(6)步骤④中的抽滤又叫减压过滤,装置如图3所示.其中抽气泵接自来水龙头的作用是起抽气作用,使吸滤瓶、安全瓶中压强减小,便于过滤.
分析 (1)萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需分液漏斗;
(2)②中合并三次萃取后的萃取液中含有产品苯甲醇、未反应的苯甲醛,及少量从水层转移过来的苯甲酸,碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸,苯甲酸是苯甲酸钠水解生成的;用水洗去可溶性杂质,饱和亚硫酸氢钠溶液洗涤目的是洗去未反应的苯甲醛;
(3)无水硫酸镁是干燥剂;题目信息中,乙醚易挥发,与空气混合易发生爆炸,蒸馏时应防止挥发到空气中;题目信息中,苯甲醇沸点为205.3℃,收集205℃~206℃的馏分得产品应是苯甲醇;
(4)题目信息中,乙醚沸点34.6℃,蒸馏除乙醚的过程中采用的加热方式应用水浴加热;石蜡油沸点高于250℃,蒸馏得产品A,应控制温度高于苯甲醇的沸点,用石蜡油油浴加热;
(5)实验步骤②中保留待用水层中主要含有苯甲酸钠,慢慢地加入到盛有浓盐酸和水的混合物中,析出白色固体为苯甲酸,由于苯甲酸溶解度受温度影响较大,可以利用重结晶方法进行提纯;
(6)连接自来水可通过水流进行抽压,利于B装置的抽滤分离,可按正常操作顺序排序.
解答 解:(1)萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需分液漏斗,故答案为:分液漏斗;
(2)②中合并三次萃取后的萃取液中含有产品苯甲醇、未反应的苯甲醛,及少量从水层转移过来的苯甲酸,碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸,苯甲酸是苯甲酸钠水解生成的,反应离子方程式为: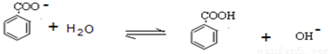 ;用水洗去可溶性杂质,故饱和亚硫酸氢钠溶液洗涤目的是洗去未反应的苯甲醛,
;用水洗去可溶性杂质,故饱和亚硫酸氢钠溶液洗涤目的是洗去未反应的苯甲醛,
故答案为:未反应完的苯甲醛;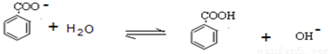 ;
;
(3)加无水硫酸镁的作用是吸收水分,起到干燥的作用;
题目信息中,乙醚易挥发,与空气混合易发生爆炸,蒸馏时锥形瓶上要加塞防止挥发到空气中;
题目信息中,苯甲醇沸点为205.3℃,收集205℃~206℃的馏分得产品应是苯甲醇,
故答案为:吸收水分;防止乙醚挥发与空气混合,发生爆炸;苯甲醇;
(4)题目信息中,乙醚沸点34.6℃,蒸馏除乙醚的过程中采用的加热方式应用水浴加热;石蜡油沸点高于250℃,蒸馏得产品A,应控制温度高于苯甲醇的沸点,用石蜡油油浴加热,
故答案为:水浴加热;石蜡油油浴加热;
(5)实验步骤②中保留待用水层中主要含有苯甲酸钠,慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体为苯甲酸,冷却,抽滤,得到粗产品,由于苯甲酸溶解度受温度影响较大,可以利用重结晶方法进行提纯,
故答案为:重结晶;
(6)步骤④中的抽滤又叫减压过滤,装置如图3所示.其中抽气泵接自来水龙头的作用是,装置接在水龙头上起抽气作用,使吸滤瓶、安全瓶中的压强减小,偏于过滤,
故答案为:起抽气作用,使吸滤瓶、安全瓶中压强减小,便于过滤.
点评 本题考查有机物制备实验,侧重考查学生对原理及操作的分析评价、物质的分离提纯等,关键是充分利用题目给予的信息进行解答,较好的考查学生分析推理能力、知识迁移运用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
| A. | 该温度下,化学平衡常数K=0.1 | |
| B. | H2S的平衡转化率为20% | |
| C. | 增大CO浓度,平衡正向移动,可以提高CO的转化率 | |
| D. | 升高温度,H2S浓度增加,表明该反应正方向是吸热反应 |
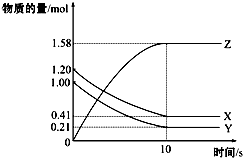 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 在前10s内用X、Y、Z表示的反应速率数值相等 |
| A. | v(C)=0.5mol/(L•min) | |
| B. | x=3 | |
| C. | B的转化率为25% | |
| D. | 若使用催化剂可以缩短达到平衡的时间,但A转化率不变 |
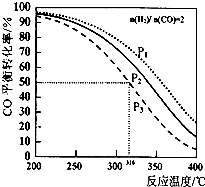 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
| A. | 铁粉作袋装食品的抗氧化剂 | B. | 二氧化硫作纸浆的漂白剂 | ||
| C. | 氢氟酸作普通玻璃的刻蚀剂 | D. | 有机溶剂作食用油的萃取剂 |