题目内容
11.下列电池工作时,负极上有H2参与反应的是( ) |  |  |  |
| A.氢燃料电池 | B.锌锰碱性电池 | C.铅蓄电池 | D.银锌纽扣电池 |
| A. | A | B. | B | C. | C | D. | D |
分析 由选项可知,只有氢氧燃料电池的负极上氢气失去电子,参与反应,以此来解答.
解答 解:A.氢燃料电池,负极上H2参与反应,失去电子被氧化,故A选;
B.锌锰碱性电池,负极上Zn失去电子,故B不选;
C.铅蓄电池,负极上Pb失去电子生成硫酸铅,故C不选;
D.银锌纽扣电池,负极上Zn失去电子,故D不选;
故选A.
点评 本题考查原电池,为高频考点,把握电极判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意常见的化学电源的工作原理,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
19.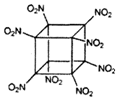 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )| A. | 分子中C、N间形成极性共价键 | B. | 1mol该分子中含8mol-NO2 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、CO2、H2O |
6.下列反应的离子方程式书写不正确的是( )
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═HSO3-+NH4+ | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向含0.1mol•L-1Na2CO3和0.2mol•L-1NaOH的混合溶液中加入等体积的0.15mol•L-1的硫酸:CO32-+3H++2OH-═2H2O+HCO3- |
16.氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡.
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此反应的a>0,△S>0.(填“>”“<”或“=”)
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.
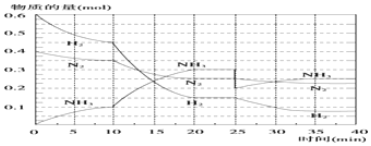
①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)?2NH3(g)+$\frac{3}{2}$O2(g)△H=a kJ•mol-1.
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
(2)一定温度和压强下,在2L的恒容密闭容器中合成氨气:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在反应过程中反应物和生成物的物质的量随时间的变化如图所示.

①0~10min内,以NH3表不的平均反应速率为0.005mol•L-1•min-1.
②在10~20min内,NH3浓度变化的原因可能是AB.
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③在反应进行至25min时,曲线发生变化的原因是移走0.1molNH3,达到第二次平衡时,新平衡的平衡常数K2=K1(填“>”“<”或“=”)
20.下列仪器名称为“圆底烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |