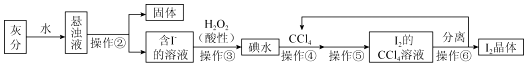
题目内容
3.煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:①2FeS2+7O2+2H2O$\frac{\underline{\;微生物\;}}{\;}$ 4H++2Fe2++4SO42-;
②Fe2++O2+H+$\frac{\underline{\;微生物\;}}{\;}$ Fe3++2H2O;
③FeS2+2Fe3+$\frac{\underline{\;微生物\;}}{\;}$ 3Fe2++2S;
④2S+3O2+2H2O $\frac{\underline{\;微生物\;}}{\;}$ 4H++2SO42-.
已知:FeS2中的硫元素为-1价.
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述②离子方程式配平并补充完整4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$ 4Fe3++2H2O.
(2)反应③的还原剂是FeS2.
(3)观察上述反应,硫元素最终转化为FeSO4、H2SO4从煤炭中分离出来.
分析 (1)依据离子方程式的电荷守恒和原子守恒书写判断产物;
(2)还原剂是元素化合价反应后升高,结合化合价变化分析判断;
(3)依据四个反应分析判断产物.
解答 解:(1)依据离子方程式的电荷守恒和原子守恒书写判断产物,②反应中为2H2O,则方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$ 4Fe3++2H2O;
故答案为:4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$ 4Fe3++2H2O;
(2)还原剂是元素化合价反应后升高,反应③中硫元素化合价从-1价变化为0价,所以反应中的还原剂是FeS2;
故答案为:FeS2;
(3)依据①②③④的离子方程式,分析判断最终的生成物为硫酸亚铁和硫酸,
故答案为:FeSO4、H2SO4.
点评 本题考查了氧化还原反应的电荷守恒、原子守恒的应用、氧化还原反应概念的分析判断,题目难度不大,掌握特征变化、分析反应实质、结合概念分析判断,侧重于考查学生的分析能力和应用能力.

练习册系列答案
相关题目
8.下列有关有机物结构、性质的分析正确的是( )
| A. | 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同 | |
| B. | 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键 | |
| C. | 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化 | |
| D. | 乙醇在铜催化作用下,能发生还原反应生成乙醛 |
15.下列化学用语错误的是( )
| A. | 乙酸的实验式CH2O | B. | 羟基电子式 | ||
| C. | 醛基的结构简式-COH | D. | 3,3-二甲基-1-戊烯的键线式 |
12.下列烷烃中,既能由烯烃加氢得到也能由炔烃加氢得到的是( )
| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 新戊烷 |
16.H3PO2是精细磷化工产品.工业制备原理如下:
Ⅰ.2P4+3Ba(OH)2+6H2O═3Ba(H2PO2)2+2PH3↑
Ⅱ.Ba(H2PO2)2+H2SO4═BaSO4↓+2H3PO2
下列推断不正确的是( )
Ⅰ.2P4+3Ba(OH)2+6H2O═3Ba(H2PO2)2+2PH3↑
Ⅱ.Ba(H2PO2)2+H2SO4═BaSO4↓+2H3PO2
下列推断不正确的是( )
| A. | 反应Ⅰ是氧化还原反应,反应Ⅱ是非氧化还原反应 | |
| B. | H3PO2具有还原性,在空气中可能被氧化成磷酸 | |
| C. | 反应Ⅰ中氧化剂与还原剂的质量之比为1:1 | |
| D. | 反应Ⅰ中,在标准状况下生成2.24 L PH3时,转移0.3 mol电子 |
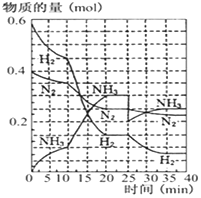 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.