题目内容
5.碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3.Ⅰ.已知25℃,101kPa时:4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1
2FeCO3(s)═2Fe(s)+2C(s)+3O2(g)△H=+1480kJ•mol-1
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ•mol-1.
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁.
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁.其反应为:Fe2O3(s)+3CH4(g)?2Fe(s)+3CO(g)+6H2(g)△H>0
①原子序数为26的铁元素位于元素周期表的第四周期.
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g.则该段时间内H2的平均反应速率为0.018mol•(L•min)-1.
③将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是bcd.
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g)?Fe(s)+CO2(g) K=0.5
若在1L密闭容器中加入0.04mol FeO(s),并通入x molCO,t℃时反应达到平衡.此时FeO(s)的转化率为50%,则x=0.06.
Ⅲ.Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O?Fe(OH)2++H+ K1
Fe(OH)2++H2O?Fe(OH)2++H+ K2
Fe(OH)2++H2O?Fe(OH)3+H+ K3
(4)以上水解反应的平衡常数K1、K2、K3由大到小的顺序是K1>K2>K3.通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O?Fex(OH)(3x-y)+y+yH+
欲使平衡正向移动可采用的方法是acd(填字母 ).
a. 加水稀释 b.加入少量NaCl固体 c. 升温 d.加入少量Na2CO3固体.
分析 I.(1)已知①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1,
③2FeCO3(s)═2Fe(s)+2C(s)+3O2(g)△H=+1480kJ•mol-1,
根据盖斯定律可知,③×2+①+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H;
II.(2)①原子序数19~36位于元素周期表的第四周期;
②△n(H2)=6×△(Fe2O3),代入v=$\frac{△n}{V•△t}$计算;
③反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,当变化的量不变时,达到化学平衡状态,据此分析;
(3)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,据此计算x值;
III.(4)多元弱碱水解时,其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步;
欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法.
解答 解:I.(1)已知①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1,
③2FeCO3(s)═2Fe(s)+2C(s)+3O2(g)△H=+1480kJ•mol-1,
根据盖斯定律可知,③×2+①+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=(+1480kJ•mol-1)×2+(-1648kJ•mol-1)+(-393kJ•mol-1)×4=-260kJ•mol-1,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ•mol-1;
II.(2)①原子序数19~36位于元素周期表的第四周期,因此原子序数为26的铁元素位于元素周期表的第四周期,
故答案为:四;
②△n(H2)=6×△(Fe2O3)=6×$\frac{4.8g}{160g/mol}$=6×0.03mol=0.18mol,
v(H2)=$\frac{△n}{V•△t}$=$\frac{0.18mol}{5L×2min}$=0.018mol•(L•min)-1,
故答案为:0.018mol•(L•min)-1;
③a.CH4的转化率等于CO的产率,与是否达到平衡状态无关,故a错误;
b.由M=$\frac{m}{n}$可知,M是一个变量,因此当混合气体的平均相对分子质量不变,达到化学平衡状态,故b正确;
c.v正(CO):v逆(H2)=1:2时,正、逆反应速率相等,达到化学平衡状态,故c正确;
d.该反应涉及固体和气体两种状态的物质,固体的总质量不变,说明达到化学平衡状态,故d正确;
故答案为:bcd;
(3)参加反应的n(FeO)=0.04mol×50%=0.02mol,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,x=0.06,
故答案为:0.06;
III.(4)多元弱碱水解时,因为每一步水解都生成氢离子,氢离子的存在抑制水解,所以其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步,则存在K1>K2>K3,
a.加水稀释,促进水解,故正确;
b.加入少量NaCl固体,对反应无影响,故b错误;
c. 水解反应为吸热反应,升温,化学平衡正向移动,故c正确;
d.加入少量Na2CO3固体,降低了氢离子浓度,化学平衡正向移动,故d正确;
故答案为:K1>K2>K3;acd.
点评 本题考查化学平衡计算、盐类水解、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析计算能力,只有反应前后改变的物理量不变时可逆反应就达到平衡状态,会化学平衡常数的有关计算,题目难度不大.

| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 新戊烷 |
Ⅰ.2P4+3Ba(OH)2+6H2O═3Ba(H2PO2)2+2PH3↑
Ⅱ.Ba(H2PO2)2+H2SO4═BaSO4↓+2H3PO2
下列推断不正确的是( )
| A. | 反应Ⅰ是氧化还原反应,反应Ⅱ是非氧化还原反应 | |
| B. | H3PO2具有还原性,在空气中可能被氧化成磷酸 | |
| C. | 反应Ⅰ中氧化剂与还原剂的质量之比为1:1 | |
| D. | 反应Ⅰ中,在标准状况下生成2.24 L PH3时,转移0.3 mol电子 |
| A. | 300 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |




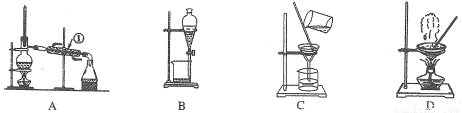
 到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
 滤 ⑦蒸发
滤 ⑦蒸发