题目内容
2.常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12.用上述NaOH溶液滴定pH=3的某一元弱酸溶液20mL,达到终点时消耗NaOH溶液13mL,试求:(1)NaOH溶液的物质的量浓度为0.04mol/L
(2)此一元弱酸的物质的量浓度为0.026mol/L
(3)求此条件下该一元弱酸的电离平衡常数为4×10-5.
分析 (1)根据盐酸和氢氧化钠混合溶液中pH计算氢氧化钠浓度,混合后溶液中剩余氢氧根离子;
(2)氢氧化钠和HA以1:1反应,NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,结合氢氧化钠和HA的关系式计算HA的浓度;
(3)电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$.
解答 解:(1)设氢氧化钠的浓度为xmol/L,盐酸和氢氧化钠混合溶液中c(OH-)=$\frac{2X-0.05×1}{1+2}mol/L=\frac{1{0}^{-14}}{1{0}^{-12}}mol/L=0.01$,x=0.04,
故答案为:0.04mol/L;
(2)氢氧化钠和HA以1:1反应,NaOH溶液12.5mL和pH=3的某一元弱酸HA溶液20.0mL恰好完全反应生成NaA,则氢氧化钠和HA的物质的量相等,
设HA的浓度为ymol/L,
0.04mol/L×0.013L=ymol/L×0.002L,
y=$\frac{0.04×0.013}{0.002}=0.026$
故答案为:0.026 mol/L;
(3)电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.026-1{0}^{-3}}$═4×10-5
故答案为:4×10-5.
点评 本题考查了pH的简单计算、电离平衡常数的计算等知识点,根据物质间的关系、混合溶液的pH、电离平衡常数公式等知识点来分析解答即可,注意酸碱混合溶液中pH的计算方法,难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
17. (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
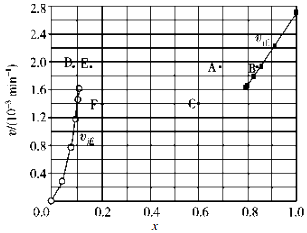
(2)Bodensteins 研究了下列反应:2HI(g)?H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为$\frac{0.10{8}^{2}}{0.78{4}^{2}}$.
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=1.95×10-3 min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为A(填字母)和E(填字母).
 (1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(1)已知反应 2HI(g)?H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.(2)Bodensteins 研究了下列反应:2HI(g)?H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=1.95×10-3 min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为A(填字母)和E(填字母).
12.下列烷烃中,既能由烯烃加氢得到也能由炔烃加氢得到的是( )
| A. | 2-甲基丙烷 | B. | 2-甲基丁烷 | C. | 2,2-二甲基丙烷 | D. | 新戊烷 |
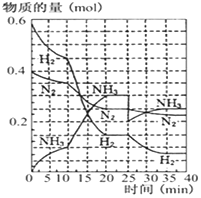 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
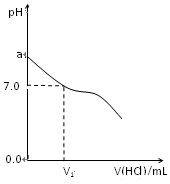 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示. 


