题目内容
13.室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为①1.0×10-7 mol•L-1 ②1.0×10-6 mol•L-1 ③1.0×10-2 mol•L-1 ④1.0×10-12 mol•L-1.( )
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
分析 室温下,pH=12的溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,如果是强碱,溶液中水电离出的c(OH-)=c(H+);如果是强碱弱酸盐,盐类水解导致溶液呈碱性,则溶液中水电离的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,据此分析解答.
解答 解:室温下,pH=12的溶液呈碱性,溶液中的溶质可能是碱或强碱弱酸盐,如果是强碱,溶液中水电离出的c(OH-)=c(H+)=10-pH=1.0×10-12 mol•L-1;如果是强碱弱酸盐,盐类水解导致溶液呈碱性,则溶液中水电离的c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=1.0×10-2 mol•L-1,故选D.
点评 本题考查溶液pH简单计算,为高频考点,侧重考查学生分析计算能力,明确溶液中溶质成分及水电离影响因素是解本题关键,注意碱中水电离出c(OH-)的计算方法,为易错点.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
3.将自来水管与下列材料做成的水龙头连接,使铁水管锈蚀最快的水龙头是( )
| A. | 塑料水龙头 | B. | 陶瓷水龙头 | C. | 铜水龙头 | D. | 铁水龙头 |
1.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d6;.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
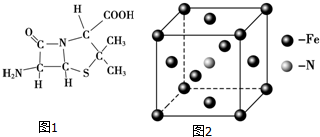
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(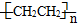 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$g•mol-1.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d6;.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
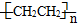 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
8.已知还原性I->Fe2+>Br-,下列离子方程式正确的是( )
| A. | 将少量Cl2通入FeBr2溶液中:Cl2+2Br-═Br2+2Cl- | |
| B. | 将足量Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将少量Cl2通入FeI2溶液中:2Fe2++2I-+3Cl2═2Fe3++2I2+6Cl- | |
| D. | 将672mLCl2(标况)通入250mL 0.1molL-1的FeI2溶液中:2Fe2++10I-+6Cl2═12Cl-+5I2+2Fe3+ |
18.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 54g H218O中含有电子总数为30NA个 | |
| B. | 11.2L H2中含有的电子数为NA个 | |
| C. | 23gNa+含有的最外层电子数为NA个 | |
| D. | 16g氧气和16g臭氧含有的核外电子总数均为8NA |
5.对于反应N2+3H2?2NH3△H<0,下列肯定不是该反应达到平衡状态的标志是( )
| A. | 断开一个N≡N,同时有六个N-H键生成 | |
| B. | 生成氨的速率与分解氨的速率相等 | |
| C. | N2、H2,、NH3的质量分数不再变化 | |
| D. | 混合气体总压不再改变 |
2.镁燃料电池具有比能量高,使用安全方便,原材料来源丰富、成本低,燃料易于贮运等特点.如图为镁一次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )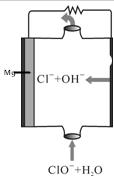

| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
7.根据不同的分类标准,同一物质可以归属不同的物质类别.K2CO3是一种盐,但不属于( )
| A. | 碳酸盐 | B. | 钾盐 | C. | 酸式盐 | D. | 正盐 |
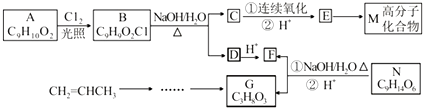
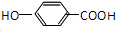 .
. .
.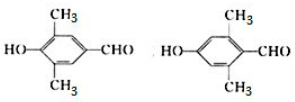 .
.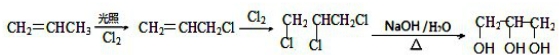 .
.