题目内容
2.镁燃料电池具有比能量高,使用安全方便,原材料来源丰富、成本低,燃料易于贮运等特点.如图为镁一次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )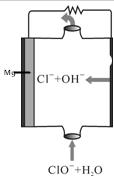
| A. | 电子由负极经电解质溶液移向正极 | |
| B. | ClO-参与的一极为正极 | |
| C. | 电池中镁为负极,发生氧化反应 | |
| D. | 放电过程中,溶液中Cl-的物质的量不变 |
分析 该燃料电池中电解质溶液呈碱性,Mg易失电子作负极,负极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,则电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,
A.电子从负极沿导线流向正极;
B.得电子化合价降低、发生还原反应的电极为正极;
C.失电子的电极发生氧化反应;
D.根据电池反应式确定氯离子浓度变化.
解答 解:该燃料电池中电解质溶液呈碱性,Mg易失电子作负极,负极反应式为Mg-2e-=Mg 2+,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,则电池反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-,
A.电子从负极沿导线流向正极,所以电子由负极Mg沿导线流向正极,故A错误;
B.得电子化合价降低、发生还原反应的电极为正极,该电池中次氯酸根离子得电子发生还原反应,所以ClO-参与的一极为正极,故B正确;
C.失电子的电极发生氧化反应,放电时,Mg失电子发生氧化反应,Mg为负极,故C正确;
D.根据电池反应式知,放电时生成氯离子,所以氯离子浓度增大,故D错误;
故选AD.
点评 本题考查化学电源新型电池,为高频考点,明确原电池中正负极判断方法、离子移动方向及电子移动分析是解本题关键,难点是电极反应式的书写,注意:放电时电子不进入电解质溶液,电解质溶液中阴阳离子定向移动形成电流,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
12.下列关于物质性质变化的比较,不正确的是( )
| A. | 稳定性:HI>HBr>HCl>HF | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:Cl-<Br-<I- |
13.室温下,在pH=12的某溶液中,由水电离的c(OH-)可能为
①1.0×10-7 mol•L-1 ②1.0×10-6 mol•L-1 ③1.0×10-2 mol•L-1 ④1.0×10-12 mol•L-1.( )
①1.0×10-7 mol•L-1 ②1.0×10-6 mol•L-1 ③1.0×10-2 mol•L-1 ④1.0×10-12 mol•L-1.( )
| A. | ①④ | B. | ③② | C. | ④ | D. | ③④ |
10.下表是元素周期表的一部分,表中的每个字母代表一种短周期元素.
(1)d元素的最高价氧化物是Al2O3;
(2)a元素位于第三周期第IA族,它的元素符号是Na;
(3)e元素原子的最外层电子数为4;
(4)a、b、c三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2(填化学式);
(5)h元素和i元素均可形成气态氢化物,其稳定性为H2h>H2i(填“大于”或“小于”);
(6)c元素和j元素形成化合物的化学式是MgCl2;
(7)j元素的单质跟氢气点燃的化学反应方程式:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)b元素的单质与水反应的离子方程式:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素两者核电荷数之差是8.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
(2)a元素位于第三周期第IA族,它的元素符号是Na;
(3)e元素原子的最外层电子数为4;
(4)a、b、c三种元素的最高价氧化物对应水化物中碱性最弱的是Mg(OH)2(填化学式);
(5)h元素和i元素均可形成气态氢化物,其稳定性为H2h>H2i(填“大于”或“小于”);
(6)c元素和j元素形成化合物的化学式是MgCl2;
(7)j元素的单质跟氢气点燃的化学反应方程式:Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl;
(8)b元素的单质与水反应的离子方程式:2K+2H2O=2OH-+2K++H2↑;
(9)f元素和g元素两者核电荷数之差是8.
17.下列晶体中由原子直接构成的单质有( )
| A. | 硫 | B. | 氦气 | C. | 金刚石 | D. | 金属镁 |
15.氢气是清洁的能源,也是重要的化工原料,有关氢气的制取研究是一个有趣的课题.根据提供两种制氢方法,完成下列各题:
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H 在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmi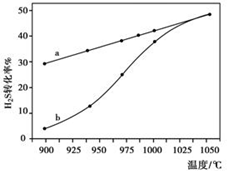 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:温度的升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
①反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)K=K1•K2•K3.(用K1、K2、K3表示)
②对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度 B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H 在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmi
 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).③请说明随温度的升高,曲线b向曲线a逼近的原因:温度的升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
②对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度 B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题: