题目内容
3.将1mol SO2和1mol O2通入密闭容器中,在一定条件下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5mol SO2,则反应达到新平衡时SO3的物质的量为( )| A. | 0.3mol | B. | 0.15mol | ||
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
分析 恒温恒容条件下,反应达到平衡时移走0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2,所到达的平衡状态,与原平衡相比,减小了压强,平衡向逆反应移动,反应物的转化率降低.
解答 解:将lmolSO2和lmolO2通入体积不变的密闭容器中,反应达到平衡时移走0.5molO2和0.5molSO2,达到新的平衡状态,该状态可以等效为开始加入时0.5molO2和0.5molSO2所到达的平衡状态,
与原平衡相比,压强降低,则化学平衡向逆反应移动,反应物转化率降低,若转化率不变时,生成的SO3的物质的量为:0.3mol×$\frac{1}{2}$=0.15mol,
由于转化率降低,故生成的SO3小于0.15mol,
故选C.
点评 本题考查化学平衡的影响因素、等效平衡在化学平衡计算中的应用,题目难度中等,构建等效平衡是解题本题的关键,注意掌握化学平衡的影响因素.

练习册系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 用NaOH溶液吸收汽车尾气中的NO2:2NO2+2OH-═NO3-+NO↑+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+2H2O═2Al(OH)3↓+HCO3- | |
| C. | 澄清石灰水和硝酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 向Na2SO3溶液中加人过量酸性KMnO4溶液:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
11.从下列实验操作、现象得出的相应结论不正确的是( )
| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 将气体通入盛饱和碳酸钠溶液的洗气瓶 | 可用于除去中CO2的HCl |
| A. | A | B. | B | C. | C | D. | D |
18.对食物的酸、碱性判断正确的是( )
| A. | 西瓜是酸性食物 | B. | 猪肉、牛肉是碱性食物 | ||
| C. | 巧克力、奶油是酸性食物 | D. | 大米、面粉是碱性食物 |
15.下列过程中所发生的化学变化属于取代反应的是( )
| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
12.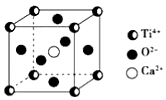 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为136 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |