��Ŀ����
1��ʵ������MnO2��Ũ���ᷴӦ��ȡ��������1����д����MnO2��ȡCl2��ѧ��ʽMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O
��2��Ũ�����ڷ�Ӧ����ʾ�����������Ǣڣ���д��ţ���
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��3����ת�Ƶ��ӵ����ʵ���Ϊ0.024molʱ�������ɵ�����ͨ��100.0mL FeCl2��Һ�У�FeCl2ȫ������������ԭFeCl2��Һ��Ũ��Ϊ0.24mol/L��
��4����ʵ����������Ҳ������KMnO4��Ũ���ᷴӦ��ȡ����������ƽ����ʽ��
2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O��
100.0mL 0.3mol/L FeSO4��Һ����Ҫ5 mL 1.2mol/LKMnO4ǡ�ý�Fe2+ȫ��������
��5��ͨ��MnO2��KMnO4��ȡ�����ıȽϣ��ȽϿ�֪��������KMnO4�� MnO2���������������
���� ��1��ʵ�����ö���������Ũ�����ڼ����������Ʊ�������
��2����������ԭ��Ӧ�У�ʧ���ӻ��ϼ����ߵ�Ԫ�ر����������������������Ӳμ��˷�Ӧ���������δ�μӷ�Ӧ����ô����ͱ��ֳ����ԣ�
��3���������Ȼ�������Һ��Ӧ�Ķ�����ϵ����ϵ����غ���㣻
��4����Ӧ��KMnO4+��MnCl2��MnԪ�ػ��ϼ���+7����Ϊ+2��������5�ۣ�Cl��Ũ����Cl2��ClԪ�ػ��ϼ���-1������Ϊ0�ۣ�������Ϊ2�ۣ����ϼ�������С������Ϊ10����KMnO4��ϵ��Ϊ2��Cl2��ϵ��Ϊ5���ٸ���ԭ���غ���ƽ�������ʵ�ϵ�������������ԭ��Ӧ�����غ���㣮
��� �⣺��1��ʵ�����ö���������Ũ�����ڼ����������Ʊ���������Ӧ����ʽΪ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O���ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
��2����Ӧ����Ԫ�صĻ��ϼ����ߣ�����Ԫ��ʧȥ���ӣ��÷�Ӧ�в���������ClԪ�ػ��ϼ۲��䡢����ClԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�����Ũ�������ᡢ��ԭ�����������Ժͻ�ԭ�ԣ�
�ʴ�Ϊ���ڣ�
��3�������ɵ�����ͨ��100.0mL FeCl2��Һ�У�FeCl2ȫ������������ӦΪ2FeCl2+Cl2=2FeCl3��2molFeCl2��Ӧ����ת��2mole-����ת�Ƶ��ӵ����ʵ���Ϊ0.024molʱ����Ӧ��FeCl2���ʵ���=0.024mol��ԭFeCl2��Һ��Ũ��=$\frac{0.024mol}{0.1L}$=0.24mol/L���ʴ�Ϊ��0.24��
��4����Ӧ��KMnO4+��MnCl2��MnԪ�ػ��ϼ���+7����Ϊ+2��������5�ۣ�Cl��Ũ����Cl2��ClԪ�ػ��ϼ���-1������Ϊ0�ۣ�������Ϊ2�ۣ����ϼ�������С������Ϊ10����KMnO4��ϵ��Ϊ2��Cl2��ϵ��Ϊ5���ٸ���ԭ���غ���ƽ�������ʵ�ϵ������ƽ��ķ���ʽΪ2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O��100.0mL 0.3mol/L FeSO4��Һ��FeSO4���ʵ���=0.3mol/L��0.1L=0.03mol������ȫ��������ת��0.03mol��1.2mol/LKMnO4ǡ�ý�Fe2+ȫ����������ԭΪMn2+����ת��1.2mol��VL��5=6Vmol��������غ�õ�6Vmol=0.03mol��V=0.005L=5ml
�ʴ�Ϊ��2��16��2��2��5��8�� 5��
��5��ͨ��MnO2��KMnO4��ȡ�����ıȽϿ�֪����������ڳ������������Ȼ��⣬�����Ը�����ش��ڶ������̣��ʴ�Ϊ������
���� ���⿼��������ԭ��Ӧ��ƽ�����㼰��������ȣ���Ŀ�Ѷ��еȣ�ע�����ճ���������ԭ��Ӧ����ƽ�����͵����غ�ļ���Ӧ�ã�

 �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�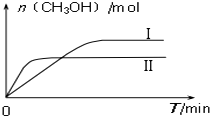 �о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����壮
�о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����壮��1��CO��������������֪��
Fe2O3��s��+3C��s��=2Fe��s��+3CO��g����H1=+489.0kJ•mol-1
C��s��+CO2��g��=2CO��g����H2=+172.5kJ•mol-1
��CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪFe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-28.5 kJ•mol-1��
��2�������¯ú���õ���CO���������Ƴ�ȼ�ϵ�أ��������Ϊ���ԣ�д����ȼ�ϵ�صĸ�����ӦʽCO+4OH--2e-=CO32-+2H2O��
��3��CO2��H2����һ��������ܱ������У��������¶��·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g�������CH3OH�����ʵ�����ʱ��ı仯ͼ��
����ͼ�жϸ÷�Ӧ��H�� 0������ I��II��Ӧ��ƽ�ⳣ��KI��KII���������=����������
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⣮
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
��һ���¶��£��˷�Ӧ�ں����ܱ������н��У����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������a b��
a��������ѹǿ���� b��H2������������� c��c��H2��=3c��CH3OH��
d���������ܶȲ��� e��2��C=O���ѵ�ͬʱ��3��C-H�γ�
��4����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2��g��+6H2��g��=CH3OCH3��g��+3H2O��g���������ѿ�����ֱ��ȼ�ϵ�أ�1mol�����ѷ��Ӿ����绯ѧ���������Բ���12NA�����ӵĵ��������ݻ�ѧ��Ӧԭ������������ѹǿ���Ʊ������ѷ�Ӧ��Ӱ��÷�Ӧ���������٣�ѹǿ����ʹƽ�����ƣ�CH3OCH3�������ӣ�ѹǿ����ʹCO��H2Ũ�����ӣ���Ӧ��������
| A�� | ũ���������㶹�� | B�� | �������峿����������� | ||
| C�� | ����ʯ��ˮ�ڿ����з��ú����� | D�� | �������ھ�ˮ |
| ���� | Mn��OH��2 | Co��OH��2 | Ni��OH��2 |
| Ksp | 2.1��10-13 | 3.0��10-16 | 5.0��10-16 |
| ���� | MnS | CoS | NiS |
| Ksp | 1.0��10-11 | 5.0��10-22 | 1.0��10-22 |
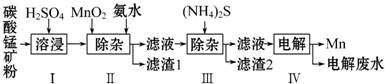
��1��������У�MnCO3�����ᷴӦ�Ļ�ѧ����ʽ��MnCO3+H2SO4=MnSO4+CO2��+H2O��
��2��������У�MnO2�����������½�Fe2+����ΪFe3+����Ӧ�����ӷ���ʽ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O���Ӱ�ˮ������Һ��pHΪ5.0��6.0���Գ�ȥFe3+��
��3��������У�����2����Ҫ�ɷ���CoS��NiS��
��4��������У��������������������������Mn���缫��ӦΪMn2++2e-=Mn��
| A�� | Fe2++Cl2��Fe3++2Cl- | |
| B�� | 2Fe2++2Br-+2I-+3Cl2=2Fe3++I2+Br2+6Cl- | |
| C�� | 2Fe2++4Br-+2I-+4Cl2��2Fe3++I2+2Br2+8Cl- | |
| D�� | 4Fe2++2Br-+2I-+4Cl2=4Fe3++I2+Br2+8Cl- |
| A�� | ����ṹ�ı���ģ�ͣ� | B�� | �ǻ��ĵ���ʽ��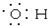 | ||
| C�� | �Ȼ��Ľṹ��ʽ��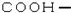 | D�� | 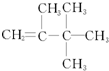 �����ƣ�2��3��3-����-1-��ϩ �����ƣ�2��3��3-����-1-��ϩ |

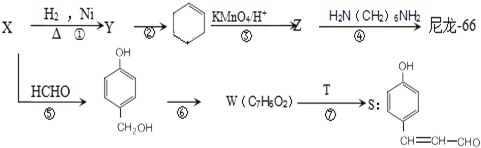
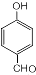 ��S�ķ���ʽΪC9H8O2��
��S�ķ���ʽΪC9H8O2��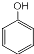 +HCHO$\stackrel{��}{��}$
+HCHO$\stackrel{��}{��}$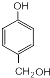 ��
��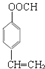 ��
��