题目内容
17.已知:SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )| A. | 肯定不含I- | B. | 肯定含SO42- | C. | 肯定含有SO32- | D. | 肯定含有NH4+ |
分析 无色溶液中加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-;由于SO32-的还原性比I-强,故I-是否存在无法判断;因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,据此进行判断.
解答 解:加入溴水仍然无色,说明溴水发生了反应,且产物无色,I-和SO32-均可与溴水反应使溴水褪色,此时反应后溶液无色,说明没有I2,则原溶液中一定有SO32-,故C正确;
由于SO32-的还原性比I-强,故I-是否存在无法判断,故A错误;
因所有离子浓度相等,则根据电荷守恒可判断SO42-肯定没有,故B错误;
根据分析可知,无法判断是否含有铵根离子,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子共存的条件,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.根据以下叙述和元素周期表的有关知识,回答下题:主族元素的性质主要由其原子的最外层电子数和电子层数决定,若元素的最外层电子数为m,电子层数为n,一般具有这样的规律:m>n的元素为非金属元素,m≤n的元素为金属元素.下列有关推断符合实际的是( )
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
5.实验室对下列药品的保存方法错误的是( )
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
2.将一小块Na投入到FeCl3溶液中,可以观察到的现象是( )
| A. | 生成白色沉淀、有气体产生 | B. | 生成红褐色沉淀、有气体产生 | ||
| C. | 生成红褐色沉淀 | D. | 生成黑色沉淀、有气体产生 |
6.锰是冶炼工业中常用的添加剂.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下,已知25℃,部分物质的溶度积常数如下:
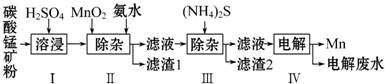
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 |
| 物质 | MnS | CoS | NiS |
| Ksp | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |

(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O.
(2)步骤Ⅱ中,MnO2在酸性条件下将Fe2+氧化为Fe3+,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(3)步骤Ⅲ中,滤渣2的主要成分是CoS和NiS.
(4)步骤Ⅳ中,在阴(填“阴”或“阳”)极析出Mn,电极反应为Mn2++2e-=Mn.
7.下列各组离子中,在溶液中能大量共存的是( )
| A. | CO32-、Cl-、Na+、H+ | B. | Al3+、K+、OH-、SO42- | ||
| C. | Ba2+、NO3-、SO42-、H+ | D. | K+、Al3+、SO42-、NO3- |

