题目内容
14.某元素R的最外层电子数是次外层电子数的2倍,由此可以判断( )| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
分析 某元素R的最外层电子数是次外层电子数的2倍,R有2个电子层时,最外层电子数为4,则R为C元素;若R有3个电子层时,不符合电子排布规律,以此来解答.
解答 解:某元素R的最外层电子数是次外层电子数的2倍,R有2个电子层时,最外层电子数为4,则R为C元素,位于第二周期第ⅣA族,
A.R一定是第2周期元素,故A正确;
B.R为ⅣA族元素,故B错误;
C.非金属性越强,对应氢化物稳定,第二周期HF的稳定性最强,故C错误;
D.R气态氢化物化学式为RH4,故D错误;
故选A.
点评 本题考查原子结构与元素的性质,为高频考点,把握原子的电子排布推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
4.在①丙烯 ②乙烯 ③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
5.在NaBr和NaI的混合物溶液中通入过量的Cl2把溶液蒸干后并将剩余物灼烧,最后剩余物质是( )
| A. | NaCl、Br2、I2 | B. | NaCl | C. | NaCl、Br2 | D. | NaCl、I2 |
2.下列表示物质结构的化学用语或模型正确的是( )
| A. | C原子外围电子排布图: | B. | 硫原子结构示意图: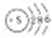 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | 苯的比例模型: |
9.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和$\frac{1}{2}$O2+H2O+2e-═2OH-则下列叙述正确的是( )
| A. | 通H2的极是正极,通入O2的极是负极 | |
| B. | 通O2的极是正极,通入H2的极是负极 | |
| C. | 工作一段时间后电解质溶液碱性增强 | |
| D. | 工作时负极区附近碱性不变 |
4.下列关于氯水的说法正确的是( )
| A. | 新制氯水中只含氯气和水分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是氯气 | |
| D. | 氯水放置数天后pH将变大 |

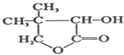 ,G的合成路线如下:
,G的合成路线如下: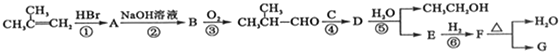
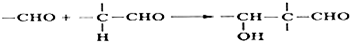
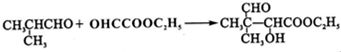 .
.