题目内容
分类是化学学习和研究的常用手段.下列分类依据和结论都正确的是( )
| A、H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B、HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C、赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |
考点:酸、碱、盐、氧化物的概念及其相互联系,离子化合物的结构特征与性质
专题:
分析:A、氧化是物由两种元素构成,其中有一种元素为氧元素的化合物;
B、氧化性酸一般是含氧酸,是指酸中除了氢、氧元素之外的中心元素在化学反应中表现出强氧化性.
C、孔雀石主要成分为碱式碳酸铜;
D、含有离子键的化合物是离子化合物,离子化合物中肯定含有离子键,可能含有共价键.
B、氧化性酸一般是含氧酸,是指酸中除了氢、氧元素之外的中心元素在化学反应中表现出强氧化性.
C、孔雀石主要成分为碱式碳酸铜;
D、含有离子键的化合物是离子化合物,离子化合物中肯定含有离子键,可能含有共价键.
解答:
解:A、氧化物是由两种元素构成,其中有一种元素为氧元素的化合物,所以H2O是氧化物,HCOOH、(NH4)2Fe(SO4)2均不是氧化物,故A错误;
B、H2SO4(浓)、HNO3均具有氧化性,是氧化性酸,但盐酸和稀硫酸不是氧化性酸,故B错误;
C、孔雀石主要成分为碱式碳酸铜,属于铜矿石,故C错误;
D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物,故D正确.
故选D.
B、H2SO4(浓)、HNO3均具有氧化性,是氧化性酸,但盐酸和稀硫酸不是氧化性酸,故B错误;
C、孔雀石主要成分为碱式碳酸铜,属于铜矿石,故C错误;
D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物,故D正确.
故选D.
点评:本题考查了氧化物、氧化性酸和常见铁矿石的俗称,难度不大,掌握基础知识是关键.

练习册系列答案
相关题目
NA为阿伏加德罗常数,下列有关说法中不正确的是( )
| A、标准状况下,22.4 L氦气含有NA个氦原子 |
| B、20 g重水含有10 NA个电子 |
| C、12.5 mL l6 mol?L-1浓硫酸与足量铜反应,转移电子数为0.2 NA |
| D、1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA |
下列用来表示物质变化的方程式正确的是( )
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- | ||||
B、以金属Pt为阳极电解硫酸铜溶液:2Cu2++2H2O
| ||||
C、硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH-
| ||||
| D、强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+H+ |
下列说法不正确的是( )
| A、纯碱不是碱 |
| B、卤代烃不是烃 |
| C、干冰不是冰 |
| D、复盐不是盐 |
下列说法正确的是( )
| A、凡是吸热反应都需要加热 |
| B、物质的化学变化都伴随着能量变化 |
| C、任何反应中的能量变化都表现为热量变化 |
| D、拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
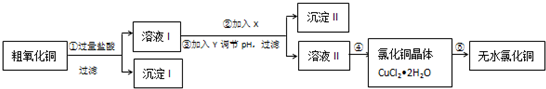
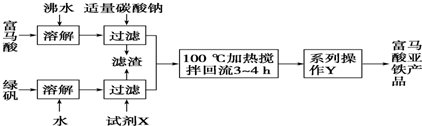
 )是一种限量使用的铁强化剂.
)是一种限量使用的铁强化剂.