题目内容
A、B、C、D四种元素均属于短周期元素,且原子序数依次增大,A与B能组成原子数之比为2:1的化合物X和1:1的化合物Y,D与B也能组成原子数之比为2:1的化合物M和1:1的化合物Z;1molC单质跟水反应放出0.5mol气体B,1molD单质跟X反应放出11.2L(标准)气体A,1molZ化合物跟X反应放出0.5mol气体B.试回答:
(1)这四种元素形成的五种简单离子的半径大小顺序为 ;
(2)这四种元素的原子半径大小顺序为 ;
(3)由B和C组成的化合物的分子式为 ;由A、B、C组成的化合物的电子式为 ,在这两种化合物中,C元素的化合价分别为 和 .
(1)这四种元素形成的五种简单离子的半径大小顺序为
(2)这四种元素的原子半径大小顺序为
(3)由B和C组成的化合物的分子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素均属于短周期元素,且原子序数依次增大,依据A与B能组成原子数之比为2:1的化合物X和1:1的化合物Y,比较原子序数推断A为氢,B为氧;X为H2O,Y为H2O2,由D与B也能组成原子数之比为2:1的化合物M和1:1的化合物Z,比较原子序数推断:D为钠;M为Na2O,
Z为Na2O2,1molC单质的化合物跟X反应放出0.5mol氧气,故C是氟;
依据1molNa单质跟水反应放出11.2L(标准)氢气,1mol过氧化钠跟水反应放出0.5mol氧气,经验证推断合理,据此解答各小题即可.
Z为Na2O2,1molC单质的化合物跟X反应放出0.5mol氧气,故C是氟;
依据1molNa单质跟水反应放出11.2L(标准)氢气,1mol过氧化钠跟水反应放出0.5mol氧气,经验证推断合理,据此解答各小题即可.
解答:
解:A、B、C、D四种元素均属于短周期元素,且原子序数依次增大,依据A与B能组成原子数之比为2:1的化合物X和1:1的化合物Y,比较原子序数推断A为氢,B为氧;X为H2O,Y为H2O2,由D与B也能组成原子数之比为2:1的化合物M和1:1的化合物Z,比较原子序数推断:D为钠;M为Na2O,
Z为Na2O2,1molC单质的化合物跟X反应放出0.5mol氧气,故C是氟;
依据1molNa单质跟水反应放出11.2L(标准)氢气,1mol过氧化钠跟水反应放出0.5mol氧气,
综上所述可知:A为氢,B为氧,C为氟,D为钠,X为水,Y为双氧水,M为氧化钠,Z为过氧化钠,
(1)H、O、F、Na形成的简单离子中氢离子只有1个电子层,故半径最小,O、F、Na形成的简单离子最外层电子数相同,原子序数越小,半径越大,故四种离子半径大小关系为:O2->F->Na+>H+,故答案为:O2->F->Na+>H+;
(2)电子层数越多,半径越大,电子层数相同,原子序数越小,半径越大,故H、O、F、Na的原子半径大小关系为:Na>O>F>H,故答案为:Na>O>F>H;
(3)O和F组成化合物,F的非金属性比O强,故显-1价,O显+2价,故此物质为OF2,由H、O、F构成的化合物为HFO,此物质类似与HClO,因为F元素吸引电子对的能力比O元素强,在次氟酸中F元素呈-1价,H元素为+1价,则O元素呈零价,次氟酸的电子式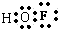 ,故答案为:OF2;
,故答案为:OF2;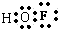 ;-1;-1.
;-1;-1.
Z为Na2O2,1molC单质的化合物跟X反应放出0.5mol氧气,故C是氟;
依据1molNa单质跟水反应放出11.2L(标准)氢气,1mol过氧化钠跟水反应放出0.5mol氧气,
综上所述可知:A为氢,B为氧,C为氟,D为钠,X为水,Y为双氧水,M为氧化钠,Z为过氧化钠,
(1)H、O、F、Na形成的简单离子中氢离子只有1个电子层,故半径最小,O、F、Na形成的简单离子最外层电子数相同,原子序数越小,半径越大,故四种离子半径大小关系为:O2->F->Na+>H+,故答案为:O2->F->Na+>H+;
(2)电子层数越多,半径越大,电子层数相同,原子序数越小,半径越大,故H、O、F、Na的原子半径大小关系为:Na>O>F>H,故答案为:Na>O>F>H;
(3)O和F组成化合物,F的非金属性比O强,故显-1价,O显+2价,故此物质为OF2,由H、O、F构成的化合物为HFO,此物质类似与HClO,因为F元素吸引电子对的能力比O元素强,在次氟酸中F元素呈-1价,H元素为+1价,则O元素呈零价,次氟酸的电子式
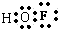 ,故答案为:OF2;
,故答案为:OF2;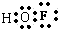 ;-1;-1.
;-1;-1.
点评:本题主要考查的是元素的推断以及元素化合物的知识,属于常考题.

练习册系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、氢氧化钡和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
| C、醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、硫酸亚铁溶液与过氧化氢溶液混合:2Fe2++H2O2+2H+═2Fe3++2H2O |
分类是化学学习和研究的常用手段.下列分类依据和结论都正确的是( )
| A、H2O、HCOOH、(NH4)2Fe(SO4)2均含有氧,都是氧化物 |
| B、HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸 |
| C、赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 |
| D、Na2CO3、Ba(OH)2、NH4Cl、Na2O2都属于离子化合物 |
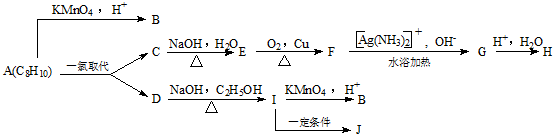
 ,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.
,芳香烃A的分子式为C8H10,在一定条件下能发生下列转化,B、H属同系物,J是一种常见的高分子塑料.