题目内容
如图表示可逆反应mA(g)+nB(g)?pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )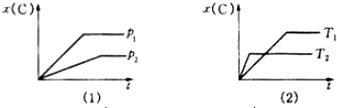
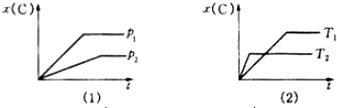
| A、吸热反应,m+n<p |
| B、吸热反应,m+n>p |
| C、放热反应,m+n<p |
| D、放热反应,m+n>p |
考点:体积百分含量随温度、压强变化曲线
专题:
分析:由达到平衡所用时间可知T2>T1,P1>P2,结合温度、压强的变化对C%的影响可解答该题.
解答:
解:由达到平衡所用时间可知T2>T1,P1>P2,升高温度,C的含量降低,说明平衡向逆反应方向移动,则正反应为放热反应;
增大压强,C的含量增大,说明平衡向正反应方向移动,则m+n>p,
故选D.
增大压强,C的含量增大,说明平衡向正反应方向移动,则m+n>p,
故选D.
点评:本题考本题考查化学平衡图象问题,题目难度不大,解答本题的关键是能把握温度、压强的大小,结合对C的含量的影响可解答该题,答题时注意图象曲线的变化趋势.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列的分离方法不正确的是( )
| A、用酒精萃取碘水中的碘 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用盐酸除去铜中混有的锌 |
| D、用淘洗的方法从沙里淘金 |
密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时同的变化如图所示.下列说法中不正确是( )

| A、该反应可以表示为A(g)+B(g)?2C(g),△H>0 |
| B、从反应开始到40min,反应物B的转化率为62.5% |
| C、30min后研究的是压强对反应速率和化学平衡的影响,40min后则是温度的影响 |
| D、在20min-30min,30min-40min的反应的平衡常数相等 |
欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向右移动,且不放出气体,可向醋酸溶液中加入少量固体( )
| A、NaOH |
| B、NaHCO3 |
| C、CH3COOK |
| D、Mg |
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,阴离子交换膜处的SO42-从右向左移动.下列分析正确的是( )


| A、A的金属活动性弱于B |
| B、Na+从y电极趋向x电极 |
| C、Y电极附近溶液先变红 |
| D、B的电极反应:B-2e-=B2+ |
下列各组反应,均可用同一离子方程式表示的是( )
| A、HCl和Na2CO3溶液反应,HCl溶液和CaCO3反应 |
| B、足量稀H2SO4和Na2CO3溶液反应,足量稀HNO3和K2CO3溶液反应 |
| C、稀H2SO4和Ba(OH)2溶液反应,稀H2SO4和KOH溶液反应 |
| D、BaCO3和稀 H2SO4溶液反应,BaCO3和稀HCl 溶液反应 |
与100mL 0.1mol/L的NaCl溶液中Cl-离子浓度相同的是( )
| A、50 mL 0.2 mol/L的NaCl溶液 |
| B、50 mL 0.05 mol/L的MgCl2溶液 |
| C、50 mL 0.2 mol/L的HCl溶液 |
| D、100 mL 0.2 mol/L的KCl溶液 |



