题目内容
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,阴离子交换膜处的SO42-从右向左移动.下列分析正确的是( )


| A、A的金属活动性弱于B |
| B、Na+从y电极趋向x电极 |
| C、Y电极附近溶液先变红 |
| D、B的电极反应:B-2e-=B2+ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中右边装置不能自发的进行氧化还原反应是不能构成原电池只能形成电解池,左边装置中能发生的进行氧化还原反应且符合原电池的构成条件所以是原电池.当K闭合时,SO42-从右向左移动,说明A为负极,B为正极,即A的金属活动性大于B;右边装置为电解氯化钠溶液的电解装置,连接B的y极为Y阳极,连接A的x极为阴极,以此解答该题.
解答:
解:A、当K闭合时,SO42-从右向左移动,说明A为负极,B为正极,即A的金属活动性大于B,故A错误;
B、y为阳极,阳离子移向阴极x,故B正确;
C、右边装置为电解氯化钠溶液的电解装置,连接B的y极为Y阳极,连接A的x极为阴极,阴极x附近变红,故C错误;
D、B为正极,发生还原反应,故D错误;
故选B.
B、y为阳极,阳离子移向阴极x,故B正确;
C、右边装置为电解氯化钠溶液的电解装置,连接B的y极为Y阳极,连接A的x极为阴极,阴极x附近变红,故C错误;
D、B为正极,发生还原反应,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力能力的考查,难度较大,明确原电池放电时溶液中颜色的变化是解本题的关键.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
在t1℃时2A(g)?B(g)达到平衡时混合气体的平均分子量为M1,t2℃时该反应的平衡混合气体的平均分子量为M2,当平衡从t1℃升温至t2℃时,下列说法中正确的是( )
| A、若M1>M2,平衡右移,△H<0 |
| B、若M1<M2,平衡右移,△H>0 |
| C、若M1>M2,平衡左移,△H>0 |
| D、若M1<M2,平衡左移,△H<0 |
如图表示可逆反应mA(g)+nB(g)?pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )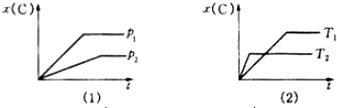
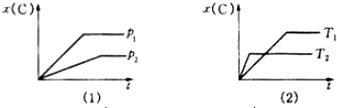
| A、吸热反应,m+n<p |
| B、吸热反应,m+n>p |
| C、放热反应,m+n<p |
| D、放热反应,m+n>p |
锑(Sb)一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe
Sb4O6+6FeS②Sb4O6+6C
4Sb+6CO↑,关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe
| ||
| ||
| A、反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B、反应②说明高温下C的还原性比Sb强 |
| C、反应①中每生成1mol FeS时,共转移3mol电子 |
| D、每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s222s2p63s23p4原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4 第一电离能最大是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g?cm-3,浓度为amol?L-1,另一份质量分数为W2,密度为 ρ2g?cm-3,浓度为b mol?L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是( )
| A、ρ1=ρ2 |
| B、ρ1<ρ2 |
| C、ρ1>ρ2 |
| D、无法比较 |
