题目内容
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3═3NaHSO4+2Na2SO4+I2+H2O.
(1)反应中 元素被氧化, 是氧化剂,1mol氧化剂转移 mol电子
(2)用单线桥表示该反应电子转移的方向和数目 .
(1)反应中
(2)用单线桥表示该反应电子转移的方向和数目
考点:氧化还原反应的计算
专题:
分析:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O中,I元素的化合价由+5价降低为0,S元素的化合价由+4价升高为+6价,以此来解答.
解答:
解:(1)反应中S元素的化合价升高,则S元素失去电子被氧化,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知,1mol氧化剂转移5mol电子,
故答案为:S;NaIO3;5;
(2)该反应中转移10e-,单线桥标出电子转移方向和数目为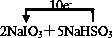 ,故答案为:
,故答案为: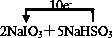 .
.
故答案为:S;NaIO3;5;
(2)该反应中转移10e-,单线桥标出电子转移方向和数目为
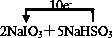 ,故答案为:
,故答案为: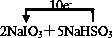 .
.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
相关题目
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示,符合图示的正确判断是( )


| A、T1>T2,△H>0 |
| B、T1>T2,△H<0 |
| C、T1<T2,△H>0 |
| D、T1<T2,△H<0 |
在同温同压下,下列各组热化学方程式中 Q1<Q2的是(反应条件已略去)( )
| A、2H2(g)+O2(g)=2H2O(l);△H=-Q1,2H2(g)+O2(g)=2H2O (g);△H=-Q2 | ||||
| B、S(g)+O2(g)=SO2(g);△H=-Q1,S(s)+O2(g)=SO2(g);△H=-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g);△H=-Q1,
|
如图表示可逆反应mA(g)+nB(g)?pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )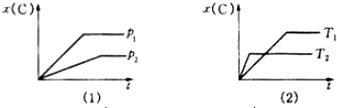
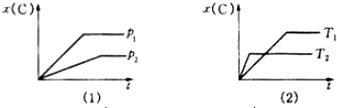
| A、吸热反应,m+n<p |
| B、吸热反应,m+n>p |
| C、放热反应,m+n<p |
| D、放热反应,m+n>p |
下列有关性质的比较中,大小顺序排列错误的是( )
| A、物质的熔点:石英>食盐>碘 |
| B、热稳定性:CH4>H2S>HCl>NH3 |
| C、下列元素的最高价氧化物的水化物酸碱性强弱:碱性:NaOH>Al(OH)3 酸性HClO4>H2SO4 |
| D、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
锑(Sb)一般以硫化物的形式存在,我国锑的蕴藏量为世界第一,从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe
Sb4O6+6FeS②Sb4O6+6C
4Sb+6CO↑,关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe
| ||
| ||
| A、反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B、反应②说明高温下C的还原性比Sb强 |
| C、反应①中每生成1mol FeS时,共转移3mol电子 |
| D、每生成4mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |

