题目内容
与100mL 0.1mol/L的NaCl溶液中Cl-离子浓度相同的是( )
| A、50 mL 0.2 mol/L的NaCl溶液 |
| B、50 mL 0.05 mol/L的MgCl2溶液 |
| C、50 mL 0.2 mol/L的HCl溶液 |
| D、100 mL 0.2 mol/L的KCl溶液 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:0.1mol/L的NaCl溶液中Cl-离子浓度为0.1mol/L,根据离子的物质的量浓度=溶质的物质的量浓度×一个溶质分子中含有的离子的个数,与溶液的体积无关判断,以此解答.
解答:
解:100mL0.1mol?L-1NaCl溶液所含Cl-物质的量浓度为0.1mol?L-1,A.50mL 0.2 mol?L-1NaCl溶液氯离子浓度为0.2 mol/L×1=0.2mol/L,故A错误;
B.50mL 0.05 mol?L-1MgCl2溶液氯离子浓度为0.05mol/L×2=0.1mol/L,故B正确;
C.50mL 0.2 mol?L-1HCl溶液氯离子浓度为0.2mol/L,故C错误;
D.100 mL 0.2 mol?L-1KCl溶液氯离子浓度为0.2mol/L,故D错误;
故选:B.
B.50mL 0.05 mol?L-1MgCl2溶液氯离子浓度为0.05mol/L×2=0.1mol/L,故B正确;
C.50mL 0.2 mol?L-1HCl溶液氯离子浓度为0.2mol/L,故C错误;
D.100 mL 0.2 mol?L-1KCl溶液氯离子浓度为0.2mol/L,故D错误;
故选:B.
点评:本题考查物质的量浓度的计算,为高频考点,侧重于学生的分析能力的考查,题目难度不大,本注意离子浓度与溶质的浓度的关系即可解答,离子浓度与溶液体积无关.

练习册系列答案
相关题目
如图表示可逆反应mA(g)+nB(g)?pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )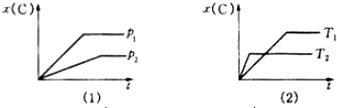
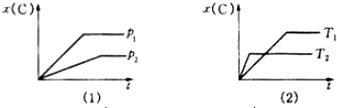
| A、吸热反应,m+n<p |
| B、吸热反应,m+n>p |
| C、放热反应,m+n<p |
| D、放热反应,m+n>p |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g?cm-3,浓度为amol?L-1,另一份质量分数为W2,密度为 ρ2g?cm-3,浓度为b mol?L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是( )
| A、ρ1=ρ2 |
| B、ρ1<ρ2 |
| C、ρ1>ρ2 |
| D、无法比较 |
下列叙述错误的是( )
| A、标准状况下,5LCH4气体与5LNH3气体的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,等体积的N2和CO气体具有相同的分子数 |
| D、室温、1标准大气压下,等质量的一氧化碳和氮气的具有相同的分子数 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、25°C时,1L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、标准状况下,1molCF4中含有的电子对数目为4.0NA |
| C、1L 0.5mol?L-1 的H2SO3溶液中含有的H+数目为NA |
| D、一定条件下1molN2与3molH2混合充分反应后生成NH3分子数小于2.0NA |
在密闭容器中进行如下反应:X2(气)+Y2(气)?2Z(气),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Y2为0.2 mol/L |
| B、Y2 为0.35 mol/L |
| C、X2 为0.2 mol/L |
| D、Z为 0.4 mol/L |