题目内容
密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时同的变化如图所示.下列说法中不正确是( )

| A、该反应可以表示为A(g)+B(g)?2C(g),△H>0 |
| B、从反应开始到40min,反应物B的转化率为62.5% |
| C、30min后研究的是压强对反应速率和化学平衡的影响,40min后则是温度的影响 |
| D、在20min-30min,30min-40min的反应的平衡常数相等 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:该题为化学平衡图象题.解化学平衡图象题,看图象:一看轴,弄清横坐标和纵坐标的意义.二看点,弄清图象上点的意义,看起点,交点,转折点,终点.三看量的变化,利用相关公式进行计算.
A、由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应;
B、根据转化率等于变化量和初始量的比值来计算;
C、由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强;
D、分析可知,30~40 min改变的条件是降低压强,故20min-30min,30min-40min温度相同.
A、由开始到达到平衡,A、B的浓度减少的量相同,由此可知x=1.则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应;
B、根据转化率等于变化量和初始量的比值来计算;
C、由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强;
D、分析可知,30~40 min改变的条件是降低压强,故20min-30min,30min-40min温度相同.
解答:
解:A、由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,反应前后气体体积不变,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡逆向移动,应是升高温度,则正反应为放热反应,△H<0,故A错误;
B、从反应开始到40min,反应物B的转化率为
×100%=62.5%,故B正确;
C、30 min时各物质的浓度均减小且正逆反应速率相同,则改变条件为增大体积(降低压强),40 min时正逆反应速率均增大,且逆反应速率大,则升高温度,故C正确;
D、分析可知,30~40 min改变的条件是降低压强,故20min-30min,30min-40min温度相同.K相同,故D正确.
故选A.
B、从反应开始到40min,反应物B的转化率为
| 2-0.75 |
| 2 |
C、30 min时各物质的浓度均减小且正逆反应速率相同,则改变条件为增大体积(降低压强),40 min时正逆反应速率均增大,且逆反应速率大,则升高温度,故C正确;
D、分析可知,30~40 min改变的条件是降低压强,故20min-30min,30min-40min温度相同.K相同,故D正确.
故选A.
点评:本题考查化学平衡图象问题,注意根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响化学反应速率的条件,本题为易错题,题目难度较大.

练习册系列答案
相关题目
某实验需要用480ml 1mol/L的氢氧化钠溶液,有关配制该溶液的叙述正确的是( )
| A、应准确称取氢氧化钠固体19.2g |
| B、为了减少损失,将氢氧化钠固体直接倒入容量瓶中,加水溶解 |
| C、定容时仰视读数,所配制的溶液浓度会偏低 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
有一无色溶液,仅含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种.为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.下列推断正确的是( )
| A、肯定有Al3+、Mg2+、Cl-,可能有NH4+、K+ |
| B、肯定有Al3+、K+、Cl-,肯定没有MnO4- |
| C、肯定有Al3+、Cl-,一定没有HCO3-和SO42- |
| D、该溶液可能显弱酸性,也可能显中性 |
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示,符合图示的正确判断是( )


| A、T1>T2,△H>0 |
| B、T1>T2,△H<0 |
| C、T1<T2,△H>0 |
| D、T1<T2,△H<0 |
在t1℃时2A(g)?B(g)达到平衡时混合气体的平均分子量为M1,t2℃时该反应的平衡混合气体的平均分子量为M2,当平衡从t1℃升温至t2℃时,下列说法中正确的是( )
| A、若M1>M2,平衡右移,△H<0 |
| B、若M1<M2,平衡右移,△H>0 |
| C、若M1>M2,平衡左移,△H>0 |
| D、若M1<M2,平衡左移,△H<0 |
如图表示可逆反应mA(g)+nB(g)?pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是( )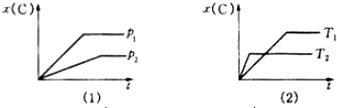
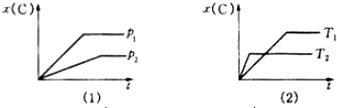
| A、吸热反应,m+n<p |
| B、吸热反应,m+n>p |
| C、放热反应,m+n<p |
| D、放热反应,m+n>p |
相同溶质的两份溶液,一份质量分数为W1,密度为ρ1g?cm-3,浓度为amol?L-1,另一份质量分数为W2,密度为 ρ2g?cm-3,浓度为b mol?L-1,若2a=b,W2<2W1,则ρ1与ρ2的大小关系是( )
| A、ρ1=ρ2 |
| B、ρ1<ρ2 |
| C、ρ1>ρ2 |
| D、无法比较 |

