题目内容
15.下图是用辉铜矿和软锰矿制备硫酸锰和碱式碳酸铜的工艺流程: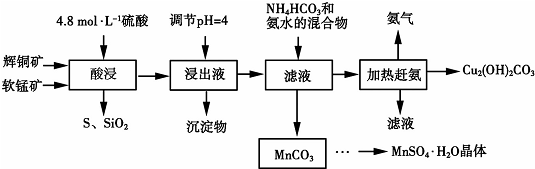
已知:①部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
③MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
④辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,另外含少量SiO2、Fe2O3等杂质.
(1)实验室需要220mL 4.8mol.L-1的稀硫酸,配制时所需的玻璃仪器除烧杯、量筒、玻
璃棒外还需要250mL容量瓶、胶头滴管.
(2)酸浸时,得到的浸出液中主要含有Cu2+、Mn2+等.写出该反应的化学方程式:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写两点).
(3)浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3.
(4)该工艺流程中可循环使用的物质是NH3 (写化学式).
(5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能的原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).
分析 流程分析可知辉铜矿软锰矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有CuSO4、MnSO4等,加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到碱式碳酸铜,滤渣为碳酸锰,通过蒸发浓缩,冷却结晶过滤洗涤得到硫酸锰晶体.
(1)根据配制一定物质量浓度溶液的仪器选择,容量瓶的规格没有220mL的,只能使用相近的250mL,定容时需要胶头滴管;
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平;矿石颗粒大小影响反应速率,温度升高反应加快,搅拌也可以提高浸取率;
(3)调节PH至4的目的是除去Fe3+离子;
(4)根据工艺流程可以看出,可循环使用的物质是氨气;
(5)晶体失去结晶水,测定硫酸锰晶体的质量分数会大于100%.
解答 解:(1)容量瓶的规格没有220mL的,只能使用相近的250mL,定容时需要胶头滴管,
故答案为:250mL容量瓶;胶头滴管;
(2)根据化合价升降,MnO2→MnSO4化合价降低2价,把Cu2S 当成整体,化合价升高:1×2+2=4,所以二氧化锰化学计量数是2,氯化亚铜的计量数是1,观察法配平其它物质,反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O;酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率,
故答案为:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O;粉碎矿石(或适当升高温度或搅拌);
(3)从表中得知PH=3.7时,Fe3+离子完全沉淀,所以浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3,
故答案为:Fe(OH)3;
(4)工艺流程中,加入了氨水,最后又得到了氨气,NH3 可循环使用,
故答案为:NH3 ;
(5)质量分数大于100%,说明了硫酸锰晶体中可能混有不分解的硫酸盐杂质或部分硫酸锰晶体失去结晶水,
故答案为:混有硫酸盐杂质或部分晶体失去结晶水.
点评 本题考查了硫酸锰和碱式碳酸铜的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等.

 阅读快车系列答案
阅读快车系列答案 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A. | 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑ | |
| B. | 断开K1,闭合K2时,铜电极作正极 | |
| C. | 断开K2,闭合K1时,石墨电极附近溶液变红 | |
| D. | 断开K1,闭合K2时,铜电极上的电极反应为:H2-2e-=2H+ |
| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加入稀释的过程中c(OH-)不断增大 | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8mol•L-1,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
①乙烯的结构简式:CH2CH2
②明矾的化学式:KAlSO4•12H2O
③CSO的电子式:

④铬原于价电子层排布图

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+
⑧淀粉的分子式:(C6H10O5)n
⑨对硝基苯酚的结构简式:

⑩Cl-的结构示意图

| A. | ③④⑤⑧ | B. | ③⑤⑧ | C. | ③⑤⑧⑨ | D. | ①③⑤⑥⑦⑧⑩ |
| A. | ω=$\frac{35a}{22.4Vρ}$×100% | |
| B. | c=$\frac{1000a}{22.4V}$ | |
| C. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω | |
| D. | 上述溶液中再加入1.5VmL同物质的量浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强酸 | |
| D. | 硒化氢是无色气体,没有H2S稳定 |
| A. | HF、NH3、CO、H2S | B. | NO、SO2、CCl4、H2O2 | ||
| C. | SO3、H2O、N2、SiF4 | D. | CO、BF3、CS2、PCl3 |
| A. | 用聚光手电筒照射,产生丁达尔效应 | |
| B. | 加入碘水,溶液变蓝 | |
| C. | 加入稀硫酸振荡并加热,再加入新制Cu(OH)2悬浊液,有红色沉淀生成 | |
| D. | 加入碘化钾溶液后,无明显现象 |
 A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体.
A是在人们日常生活中最常见的有机物,75%(体积分数)的水溶液可用于医疗消毒,B是一种植物生长调节剂,通常情况下C是一种具有果香味的无色液体.