题目内容
20.运用元素周期表的变化规律,推断下列说法不正确的是( )| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强酸 | |
| D. | 硒化氢是无色气体,没有H2S稳定 |
分析 A.Be与Al位于周期表中的对角线位置,氧化物对应水化物的性质相似;
B.卤素单质从上到下颜色加深、状态由气-液-固变化,非金属性减弱,AgX不溶于硝酸;
C.硫酸钡不溶于水和硝酸,氢氧化钡为强碱,同主族元素的化合物性质相似;
D.同主族从上到下非金属性减弱,非金属性越强,氢化物越稳定.
解答 解:A.Be与Al位于周期表中的对角线位置,氧化物对应水化物的性质相似,则铍是一种轻金属,它的氧化物对应水化物可能是两性,故A正确;
B.卤素单质从上到下颜色加深、状态由气-液-固变化,非金属性减弱,AgX不溶于硝酸,则砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀,故B正确;
C.硫酸钡不溶于水和硝酸,氢氧化钡为强碱,同主族元素的化合物性质相似,则硫酸锶难溶于水和稀HNO3,其氢氧化物为强碱,故C错误;
D.同主族从上到下非金属性减弱,非金属性S>Se,则硒化氢是无色气体,没有H2S稳定,故D正确;
故选C.
点评 本题考查周期表与周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答该题的关键,侧重于学生的分析能力和应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下表是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式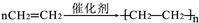 ;
;
(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 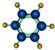 |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式
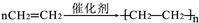 ;
;(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
11.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
8.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:
(1)在①-⑩元素中,化学性质最不活泼的元素是Ar(填元素符号).
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
15.下图是用辉铜矿和软锰矿制备硫酸锰和碱式碳酸铜的工艺流程:
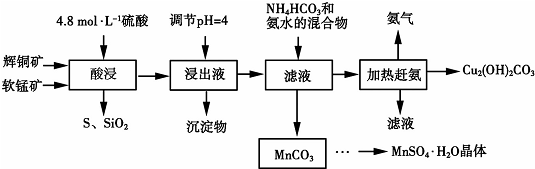
已知:①部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
②[Cu(NH3)4]S04常温稳定,在热水溶液中会分解生成NH3
③MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
④辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,另外含少量SiO2、Fe2O3等杂质.
(1)实验室需要220mL 4.8mol.L-1的稀硫酸,配制时所需的玻璃仪器除烧杯、量筒、玻
璃棒外还需要250mL容量瓶、胶头滴管.
(2)酸浸时,得到的浸出液中主要含有Cu2+、Mn2+等.写出该反应的化学方程式:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写两点).
(3)浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3.
(4)该工艺流程中可循环使用的物质是NH3 (写化学式).
(5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能的原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).

已知:①部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
③MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
④辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,另外含少量SiO2、Fe2O3等杂质.
(1)实验室需要220mL 4.8mol.L-1的稀硫酸,配制时所需的玻璃仪器除烧杯、量筒、玻
璃棒外还需要250mL容量瓶、胶头滴管.
(2)酸浸时,得到的浸出液中主要含有Cu2+、Mn2+等.写出该反应的化学方程式:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写两点).
(3)浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3.
(4)该工艺流程中可循环使用的物质是NH3 (写化学式).
(5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能的原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).
5.如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )
| W | Z | |
| X | Y |
| A. | 原子半径:Z<W<Y<X | |
| B. | Z的最高价氧化物的水化物可与其氢化物反应 | |
| C. | 最简单气态氢化物的热稳定性:Y<W | |
| D. | W、Z的氧化物都能与碱反应生成盐和水 |
12.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 正戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
10.下列有关物质的分类或归类正确的是( )
| A. | 单质:硫磺、石英、水银 | B. | 化合物:盐酸、食盐、烧碱 | ||
| C. | 混合物:空气、胶体、海水 | D. | 非电解质:铜、蔗糖、酒精 |

