题目内容
6.下列说法错误的是( )| A. | 等物质的量的NaX和弱酸HX混合后的溶液中c(HX)可能大于c(X-) | |
| B. | 在pH=4.5的NaHSO3溶液中,c(H2SO3)大于c(SO32-) | |
| C. | 向0.1 mol/L醋酸溶液中加入稀释的过程中c(OH-)不断增大 | |
| D. | 0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8mol•L-1,则该溶液中由水电离出的c(H+)=1×10-11mol•L-1 |
分析 A.如水解程度大于电离,则c(HX)大于c(X-);
B.pH=4.5,说明HSO3-电离大于水解程度;
C.加水解释,c(H+)减小;
D.酸溶液中的氢氧根离子是水电离的,结合水的离子积计算出该溶液中氢离子浓度,然后可计算出水电离的氢离子浓度.
解答 解:A.等物质的量的NaX和弱酸HX混合后,如溶液呈碱性时,说明水解程度大于电离,则c(HX)大于c(X-),故A正确;
B.pH=4.5,说明HSO3-电离大于水解程度,则c(H2SO3)小于c(SO32-),故B错误;
C.加水解释后溶液中c(H+)减小,而Kw不变,则c(OH-)不断增大,故C正确;
D.根据$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8mol•L-1和c(H+)×c(OH-)=10-14可知,溶液中$\frac{\frac{c({H}^{+})}{1{0}^{-14}}}{c({H}^{+})}$=1×10-8mol•L-1,解得:c(H+)=0.001mol/L,HA溶液中的氢氧根离子是水电离的,则由水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{0.001}$mol/L=10-11mol/L,故D正确;
故选B.
点评 本题考查电解质的电离和盐类的水解,属于综合知识的考查,为高频考点,题目难度中等,明确电离平衡及其影响因素为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
17.某研究性学习小组在实验室中配制1mol•L-1的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液,下列有关说法错误的是:( )
| A. | 实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | |
| B. | 如果实验中需用60 mL的稀硫酸标准溶液,配制时应选用100 mL容量瓶 | |
| C. | 酸式滴定管用蒸馏水洗涤后,即装入稀硫酸,则测得的NaOH溶液的浓度将偏大 | |
| D. | 滴定终点时,仰视滴定管的刻度,其他操作正确,测得的NaOH溶液的浓度将偏小 |
1.在铜与稀硝酸的反应中,如果有1mol的硝酸被还原,则被氧化的铜的物质的量为( )
| A. | 3 mol | B. | $\frac{3}{2}$mol | C. | $\frac{3}{8}$mol | D. | $\frac{8}{3}$mol |
11.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
18.H-H键的键能是436kJ•mol-1,I-I键的键能是151kJ•mol-1,H-I键的键能是299kJ•mol-1.则对反应H2(g)+I2(g)?2HI(g)的说法,不正确的是( )
| A. | 氧化还原反应 | B. | 放热反应 | C. | 化合反应 | D. | 吸热反应 |
15.下图是用辉铜矿和软锰矿制备硫酸锰和碱式碳酸铜的工艺流程:
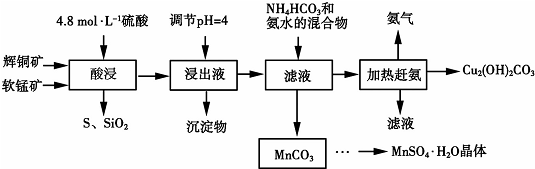
已知:①部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
②[Cu(NH3)4]S04常温稳定,在热水溶液中会分解生成NH3
③MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
④辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,另外含少量SiO2、Fe2O3等杂质.
(1)实验室需要220mL 4.8mol.L-1的稀硫酸,配制时所需的玻璃仪器除烧杯、量筒、玻
璃棒外还需要250mL容量瓶、胶头滴管.
(2)酸浸时,得到的浸出液中主要含有Cu2+、Mn2+等.写出该反应的化学方程式:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写两点).
(3)浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3.
(4)该工艺流程中可循环使用的物质是NH3 (写化学式).
(5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能的原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).

已知:①部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 物质 | Cu(OH)2 | Fe(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 8.3 | 1.4 |
| 沉淀完全pH | 13 | 14 | 9.8 | 3.7 |
③MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫
④辉铜矿主要成分为Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,另外含少量SiO2、Fe2O3等杂质.
(1)实验室需要220mL 4.8mol.L-1的稀硫酸,配制时所需的玻璃仪器除烧杯、量筒、玻
璃棒外还需要250mL容量瓶、胶头滴管.
(2)酸浸时,得到的浸出液中主要含有Cu2+、Mn2+等.写出该反应的化学方程式:2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O.酸浸时,为了提高浸取率可采取的措施有粉碎矿石(或适当升高温度或搅拌)(任写两点).
(3)浸出液的pH调至4时,所得主要沉淀物的化学式为Fe(OH)3.
(4)该工艺流程中可循环使用的物质是NH3 (写化学式).
(5)用标准的BaCl2溶液测定样品中MnSO4•H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能的原因有混有硫酸盐杂质或部分晶体失去结晶水(任写一种).
16.按官能团分类,下列说法不正确的是( )
| A. |  属于醇类 属于醇类 | B. |  属于羧酸 属于羧酸 | C. |  属于酮类 属于酮类 | D. |  属于酚类 属于酚类 |