题目内容
欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.三种金属离子生成沉淀的pH如右表.
某含铬废水处理的主要流程如图所示:
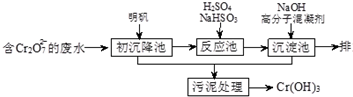
(1)初沉降池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) .
(2)请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ = Cr3++ SO42-+ H2O.
(3)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 .证明Cr3+沉淀完全的方法是 .
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |

(1)初沉降池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
(2)请补充并配平以下反应池中发生主要反应的离子方程式:
(3)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和
考点:"三废"处理与环境保护
专题:元素及其化合物
分析:(1)含Cr2O72-废水中加入明矾,铝离子水解生成具有吸附性的氢氧化铝,可除去水的悬浮物杂质;
(2)加入硫酸和亚硫酸钠,在酸性条件下发生氧化还原反应,根据得失电子守恒配平;
(3)加入氢氧化钠溶液可生成Cr(OH)3沉淀,分离后可达到排放的目的.
(2)加入硫酸和亚硫酸钠,在酸性条件下发生氧化还原反应,根据得失电子守恒配平;
(3)加入氢氧化钠溶液可生成Cr(OH)3沉淀,分离后可达到排放的目的.
解答:
解:(1)K2SO4﹒Al2(SO4)3﹒24H2O为强电解质,在溶液中完全电离,生成Al3+和SO42-、K+,Al3+能水解生成氢氧化铝胶体:Al3++3H2O=Al(OH)3(胶体)+3H+或Al3++3H2O?Al(OH)3+3H+,氢氧化铝胶体具有吸附性,能吸附水中的悬浮物,所以能作净水剂,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)反应中,Cr2O72-中铬元素化合价变化为:+6→+3,化合价降低了3价,Cr2O72-中含有两个铬原子,至少降低6价;
HSO3-中硫元素化合价变化为:+4→+6,化合价升高了(6-4)=2价,化合价变化的最小公倍数为6,所以Cr2O72-的化学计量数为1,亚硫酸氢根离子计量数为3,铬离子计量数为2,硫酸根离子计量数为3,再根据电荷守恒,氢离子计量数为5,最后根据质量守恒判断,未知物为水,计量数为4,配平后的方程式为:Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,
故答案为:1;3;5H+;2;3;4;
(3)向转化后的废水中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据表中数据可知,Cr(OH)3沉淀完全时,溶液的pH为8,所以测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-=Cr(OH)3↓;取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
故答案为:Al3++3H2O?Al(OH)3+3H+;
(2)反应中,Cr2O72-中铬元素化合价变化为:+6→+3,化合价降低了3价,Cr2O72-中含有两个铬原子,至少降低6价;
HSO3-中硫元素化合价变化为:+4→+6,化合价升高了(6-4)=2价,化合价变化的最小公倍数为6,所以Cr2O72-的化学计量数为1,亚硫酸氢根离子计量数为3,铬离子计量数为2,硫酸根离子计量数为3,再根据电荷守恒,氢离子计量数为5,最后根据质量守恒判断,未知物为水,计量数为4,配平后的方程式为:Cr2O72-+3HSO3-+5H+═2Cr3++3SO42-+4H2O,
故答案为:1;3;5H+;2;3;4;
(3)向转化后的废水中加入NaOH溶液,NaOH会和H+发生反应H++OH-═H2O,Cr3+与NaOH发生反应Cr3++3OH-═Cr(OH)3↓,根据表中数据可知,Cr(OH)3沉淀完全时,溶液的pH为8,所以测定溶液的pH,若pH≥8,则证明Cr3+沉淀完全,
故答案为:Cr3++3OH-=Cr(OH)3↓;取沉淀后的上层清液测定其pH,若pH≥8,则沉淀完全.
点评:本题考查了探究物质的组成、电解原理等知识,题目难度较大,试题综合性较强,涉及了电解原理、氧化还原反应配平、化学方程式的计算等问题,培养了学生的分析、理解能力及灵活应用所学知识解决问题的能力,有利于提高学生的实验设计能力和应试能力,提升学生的学科素养.

练习册系列答案
相关题目
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O.如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下列选项中由实验现象得出的结论完全正确的是( )


| A、滴有KSCN的FeCl2溶液变红色Cl2具有还原性 |
| B、滴有酚酞的NaOH溶液褪色 Cl2具有酸性 |
| C、石蕊溶液先变为红色后褪色Cl2具有漂白性 |
| D、KI淀粉溶液中变蓝色 Cl2具有氧化性 |
NaHS、MgSO4、NaHSO4三种物质组成的混合物中,已知氧元素的质量分数为a%,则其中硫元素的质量分数为( )
| A、a% | ||
| B、1-1.75 a% | ||
C、
| ||
D、
|
制备相同质量的硝酸铜,从经济效益和环保角度考虑,最适宜采用的方法是( )
| A、Cu+HNO3(浓)→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
| C、Cu+AgNO3→Cu(NO3)2 | |||||
D、Cu
|
下列处置、操作或现象的描述中正确的是( )
①漂白粉露置在空气中保存
②金属镁着火时,可用CO2灭火
③让一束光通过胶体,会出现一条光亮的“通路”
④有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑.
①漂白粉露置在空气中保存
②金属镁着火时,可用CO2灭火
③让一束光通过胶体,会出现一条光亮的“通路”
④有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑.
| A、①② | B、①③ | C、②④ | D、③④ |
下列说法不正确的是( )
| A、分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| B、对有机物分子红外光谱图的研究有助于确定有机物分子中的基团 |
| C、分子式C4H10表示的物质必是纯净物 |
D、有机物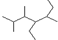 的名称:2,3,5-三甲基-4-乙基庚烷 的名称:2,3,5-三甲基-4-乙基庚烷 |
 科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性.某学生用如图所示方法研究物质的性质,其中,气体A的主要成分是氯气(含有空气和水蒸气).请回答下列问题:
科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性.某学生用如图所示方法研究物质的性质,其中,气体A的主要成分是氯气(含有空气和水蒸气).请回答下列问题: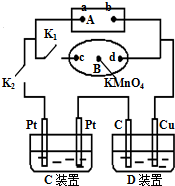 (1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.
(1)如图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料见图,电解质溶液见已知.