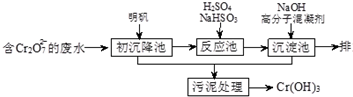
题目内容
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O.如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下列选项中由实验现象得出的结论完全正确的是( )


| A、滴有KSCN的FeCl2溶液变红色Cl2具有还原性 |
| B、滴有酚酞的NaOH溶液褪色 Cl2具有酸性 |
| C、石蕊溶液先变为红色后褪色Cl2具有漂白性 |
| D、KI淀粉溶液中变蓝色 Cl2具有氧化性 |
考点:氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:根据反应KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O可知,将浓盐酸滴在KClO3晶体上,有Cl2生成,Cl2具有强氧化性,能氧化FeCl2,与水反应生成HCl和具有强氧化性的HClO,溶液呈酸性并具有强氧化性,能使石蕊试液先变红后褪色,能氧化酚酞而使酚酞溶液褪色,与KI反应生成I2,淀粉溶液变蓝,以此来解答.
解答:
解:A.将浓盐酸滴在KClO3晶体上,有Cl2生成,Cl2具有强氧化性,能氧化FeCl2生成FeCl3,铁离子和硫氰酸钾溶液反应生成血红色溶液,故A错误;
B.氯气可氧化酚酞,且Cl2+2OH-=Cl-+ClO-+H2O,碱性减弱溶液也褪色,但氯气不具有酸性,故B错误;
C.Cl2与水反应生成HCl和具有强氧化性的HClO,溶液呈酸性并具有强氧化性,能使石蕊试液先变红后褪色,表现出HClO的漂白性,而氯气不具有漂白性,故C错误;
D.Cl2具有强氧化性,与KI反应生成I2,淀粉溶液变蓝,反应的离子方程式Cl2+2I-=2Cl-+I2,故D正确;
故选D.
B.氯气可氧化酚酞,且Cl2+2OH-=Cl-+ClO-+H2O,碱性减弱溶液也褪色,但氯气不具有酸性,故B错误;
C.Cl2与水反应生成HCl和具有强氧化性的HClO,溶液呈酸性并具有强氧化性,能使石蕊试液先变红后褪色,表现出HClO的漂白性,而氯气不具有漂白性,故C错误;
D.Cl2具有强氧化性,与KI反应生成I2,淀粉溶液变蓝,反应的离子方程式Cl2+2I-=2Cl-+I2,故D正确;
故选D.
点评:本题考查氯气的性质及氧化还原反应,为高频考点,把握发生的反应、现象及氧化还原反应的应用为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是:①NO和O2,②N2和NO2,③NH3和NO,现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
| A、V1>V2>V3 |
| B、V1>V3>V2 |
| C、V2>V3>V1 |
| D、V3>V1>V2 |
等质量的下列有机物,完全然燃烧需要的氧气的量最多的是( )
| A、苯 | B、甲烷 | C、乙烷 | D、十七烷 |
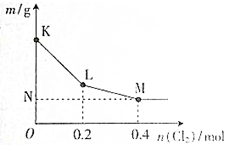 向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )
向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )| A、K→L段发生反应的离子方程式为2Br-+Cl2═2Cl-+Br2 |
| B、原溶液中,c(Na+ )=4mol?L-1 |
| C、原溶液中,c(I-)=2mol?L-1 |
| D、M点代表的固体质量为46.8g |
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;④0.01mol/L NaOH溶液.下列说法正确的是( )
| A、四份溶液中水的电离程度由大到小的顺序为:①=②=④<③ |
| B、若将②、③等体积混合,则混合液的pH为7 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① |
| D、若在10mL①中加入④至pH刚好等于7,则C(Na+)=C(CH3COO-),混合溶液总体积<20mL(假设混和溶液体积为酸和碱溶液体积之和) |
在醋酸溶液中,加入下列物质不影响醋酸电离平衡的是 ( )
| A、Na |
| B、CaCO3 |
| C、BaCl2 |
| D、NaHSO4 |