题目内容
6.密闭容器中盛有一定量的CH4与O2混合气体及足量的Na2O2固体,电火花点燃充分反应后,恢复至室温,发现容器为真空,则原混合气中CH4与O2的体积比为( )| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
分析 甲烷完全燃烧生成CO2和H2O,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,固体相当于吸收CO,水蒸汽与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,固体吸收相当于H2,由于恢复至室温,发现容器为真空,说明气体完全被吸收,则CH4与O2的混合组成可以表示为xCO.yH2,由C、O原子数目之比可知CH4与O2的体积之比.
解答 解:甲烷完全燃烧生成CO2和H2O,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,固体相当于吸收CO,水蒸汽与过氧化钠发生反应:2H2O+2Na2O2=4NaOH+O2,固体吸收相当于H2,由于恢复至室温,发现容器为真空,说明气体完全被吸收,则CH4与O2的混合组成可以表示为xCO.yH2,由C、O原子数目之比可知,CH4与O2的物质的量之比为2:1,故原混合气中CH4与O2的体积比为2:1,
故选:A.
点评 本题考查混合物有关计算,注意根据方程式理解固体吸收物质组成,侧重考查学生分析思维与解题方法技巧的能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
16.下列与化学概念有关的说法正确的是( )
| A. | CO2、SO2都是酸性氧化物 | |
| B. | 盐类物质一定含有金属离子 | |
| C. | H2O、HCOOH、(NH4)2Fe(SO4)2中均含有氧元素,都是氧化物 | |
| D. | 凡能电离出H+的化合物均属酸 |
17.将下列各组物质按酸、碱、盐分类顺序排列正确的是( )
| A. | 硫酸 纯碱 硫酸钠 | B. | 氢溴酸 烧碱 绿矾 | ||
| C. | 碳酸 乙酸 醋酸钠 | D. | 磷酸 熟石灰 苛性钠 |
14.设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气在标准状况下的体积为11.2L | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的氯化镁溶液中,含有氯离子个数为NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA |
1.下列说法正确的是( )
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
11.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].图1是实验室模拟制备的操作流程:
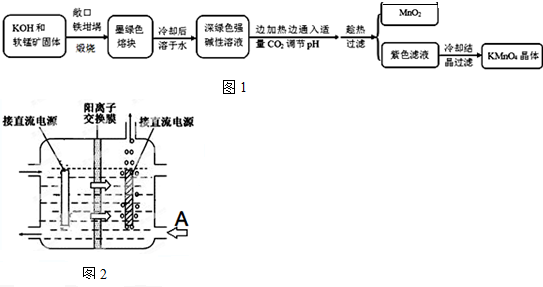
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;
其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是高温下强碱会和瓷坩埚中的二氧化硅反应腐蚀坩埚;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;
其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图).图2中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
18.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如图:下列说法不正确的是( )


| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
15.下列关于氯及其化合物的说法正确的是( )
| A. | 氯气和液氯是两种不同的物质 | |
| B. | Cl2通入到含有酚酞的NaOH溶液中红色褪去,因为氯气有漂白性 | |
| C. | Cl2在化学反应中既能作氧化剂,又能作还原剂 | |
| D. | 新制的氯水呈酸性,向其中滴加几滴紫色石蕊试液并振荡,溶液呈红色 |
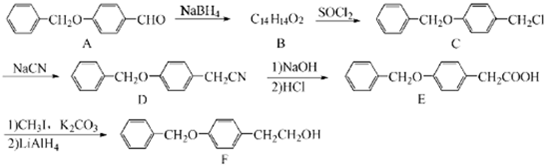
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应.
 为原料制备
为原料制备 的合成路线示意图(无机试剂任用).合成路线示意图例如题干.
的合成路线示意图(无机试剂任用).合成路线示意图例如题干.