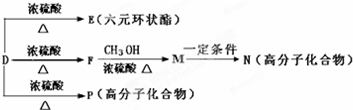
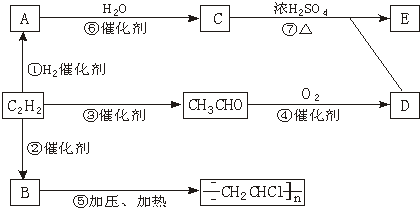
题目内容
KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到的KMnO4溶液贮存于棕色试剂瓶并放在暗处;④利用氧化还原滴定方法,用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度,KMnO4在滴定中被还原成Mn2+.请回答下列问题:
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是 .
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用 (填序号).
A.质量分数为30%的双氧水 B.FeSO4 C.摩尔盐 D.Na2SO3
(3)本实验也可采用H2C2O4?2H2O做基准试剂,准确称取W g H2C2O4?2H2O溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点的实验现象为 ,若消耗KMnO4溶液V mL.KMnO4溶液的物质的量浓度为 mol?L-1.
(4)采用H2C2O4?2H2O做基准试剂的氧化还原滴定在室温时反应很慢,所以反应需要在70~80℃条件下进行,但温度更高会导致草酸分解产生气体,写出草酸分解的化学反应方程式 ,若如此所测得的高锰酸钾标准液浓度会 (填“偏高”、“偏低”或“无影响”).即使控制70~80℃条件,一开始滴定时反应仍然较慢,若滴加KMnO4溶液过快的话,会造成KMnO4溶液浓度局部过高而分解,因此在开始几滴操作时应 ,在滴入几滴KMnO4溶液之后,反应速率会迅速加快,该滴定操作也可相应加快,反应速率加快的原因是 .
(5)若用放置两周后的KMnO4标准溶液去测定水样中Fe2+的含量,测得的Fe2+浓度值将 (填“偏高”、“偏低”或“无影响”).
(1)准确量取一定体积的KMnO4溶液需要使用的仪器是
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用
A.质量分数为30%的双氧水 B.FeSO4 C.摩尔盐 D.Na2SO3
(3)本实验也可采用H2C2O4?2H2O做基准试剂,准确称取W g H2C2O4?2H2O溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点的实验现象为
(4)采用H2C2O4?2H2O做基准试剂的氧化还原滴定在室温时反应很慢,所以反应需要在70~80℃条件下进行,但温度更高会导致草酸分解产生气体,写出草酸分解的化学反应方程式
(5)若用放置两周后的KMnO4标准溶液去测定水样中Fe2+的含量,测得的Fe2+浓度值将
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)高锰酸钾溶液具有强氧化性,不能使用碱式滴定管,可以选用酸式滴定管量取高锰酸钾溶液;
(2)选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂;
(3)滴定终点时最后滴下1滴KMnO4溶液后半分钟不褪色;先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
(4)草酸不稳定,受热分解生成水、二氧化碳和一氧化碳气体,据此写出分解方程式,草酸分解导致浓度偏小,导致滴定时消耗高锰酸钾体积增偏小,由此测得高锰酸钾浓度偏高;防止高锰酸钾分解,开始时应慢慢滴加,待前一滴KMnO4溶液完全褪色后再滴下一滴;草酸标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
(5)长时间放置后,高锰酸钾溶液浓度变小,滴定过程中消耗的标准液-高锰酸钾溶液的体积偏大,测定出的亚铁离子的含量偏高.
(2)选做基准试剂的物质必须满足纯度高、稳定性好,如硫酸亚铁、亚硫酸钠容易被氧化变质的试剂不能作为基准试剂;
(3)滴定终点时最后滴下1滴KMnO4溶液后半分钟不褪色;先计算草酸的物质的量浓度,再根据草酸和高锰酸钾之间的关系式计算高锰酸钾的物质的量浓度;
(4)草酸不稳定,受热分解生成水、二氧化碳和一氧化碳气体,据此写出分解方程式,草酸分解导致浓度偏小,导致滴定时消耗高锰酸钾体积增偏小,由此测得高锰酸钾浓度偏高;防止高锰酸钾分解,开始时应慢慢滴加,待前一滴KMnO4溶液完全褪色后再滴下一滴;草酸标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
(5)长时间放置后,高锰酸钾溶液浓度变小,滴定过程中消耗的标准液-高锰酸钾溶液的体积偏大,测定出的亚铁离子的含量偏高.
解答:
解:(1)高锰酸钾溶液具有强氧化性,量取时应该选用酸式滴定管,
故答案为:酸式滴定管;
(2)A.过氧化氢不稳定,光照易分解,不易用作基准试剂,故A错误;
B.FeSO4?7H2O在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.硫酸亚铁铵,俗名摩尔盐,在空气中比硫酸亚铁稳定,有还原性,在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,故C正确;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故选:C;
(3)滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;
草酸的物质的量浓度为:
=
mol/L,
根据反应方程式6H++2MnO4-+5H2C2O4?2H2O═2Mn2++10CO2↑+18H2O,
2mol 5mol
c×VmL
mol/L×25mL
酸性高锰酸钾的物质的量浓度c=
=
mol/L;
故答案为:最后一滴KMnO4溶液滴下,溶液颜色从无色变成浅红色,且半分钟内不褪色;
mol/L;
(4)草酸不稳定,受热分解生成水、二氧化碳和一氧化碳气体,反应方程式为:H2C2O4
H2O+CO+CO2,草酸分解导致浓度偏小,导致滴定时消耗高锰酸钾体积V偏小,根据酸性高锰酸钾的物质的量浓度c=
mol/L表达式可知测得高锰酸钾浓度偏高;防止高锰酸钾分解,开始时应慢慢滴加,待前一滴KMnO4溶液完全褪色后再滴下一滴;草酸钠标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大;
草酸标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大,
故答案为:H2C2O4
H2O+CO+CO2;偏高;慢慢滴加,待前一滴KMnO4溶液完全褪色后再滴下一滴;生成的Mn2+催化了该反应的进行;
(5)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,反应的离子方程式为:8H++MnO4-+5Fe2+═Mn2++5Fe3++4H2O,
故答案为:偏高.
故答案为:酸式滴定管;
(2)A.过氧化氢不稳定,光照易分解,不易用作基准试剂,故A错误;
B.FeSO4?7H2O在空气中不稳定,亚铁离子容易被氧化成铁离子,不宜用作基准试剂,故B错误;
C.硫酸亚铁铵,俗名摩尔盐,在空气中比硫酸亚铁稳定,有还原性,在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,故C正确;
D.Na2SO3具有还原性,在空气中容易被氧化成硫酸钠,不宜用作基准试剂,故D错误;
故选:C;
(3)滴定时滴入最后一滴,高锰酸钾不反应,溶液变成紫红色并保持半分钟不褪色,说明滴定到达终点;
草酸的物质的量浓度为:
| ||
| 0.5L |
| W |
| 63 |
根据反应方程式6H++2MnO4-+5H2C2O4?2H2O═2Mn2++10CO2↑+18H2O,
2mol 5mol
c×VmL
| W |
| 63 |
酸性高锰酸钾的物质的量浓度c=
2mol×
| ||
| 5mol×VmL |
| 10W |
| 63V |
故答案为:最后一滴KMnO4溶液滴下,溶液颜色从无色变成浅红色,且半分钟内不褪色;
| 10W |
| 63V |
(4)草酸不稳定,受热分解生成水、二氧化碳和一氧化碳气体,反应方程式为:H2C2O4
| ||
| 10W |
| 63V |
草酸标定高锰酸钾溶液的浓度,反应过程中生成的锰离子可能是起到了催化剂作用,反应速率增大,
故答案为:H2C2O4
| ||
(5)在放置过程中,由于空气中还原性物质的作用,使KMnO4溶液的浓度变小了,再去滴定水样中的Fe2+时,需要消耗KMnO4溶液(标准溶液)的体积会增大,导致计算出来的c(Fe2+)值会增大,测定的结果偏高,反应的离子方程式为:8H++MnO4-+5Fe2+═Mn2++5Fe3++4H2O,
故答案为:偏高.
点评:本题考查了滴定实验,题目难度中等,明确滴定原理是解答本题的关键,注意基准试剂的选取方法,(3)为难点和易错点,注意滴定终点现象不是褪色,而是变成紫红色.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
下列过程表达式中,属于电离方程式的是( )
| A、HCO3-+H2O?H2CO3+OH- |
| B、HS-+H2O?S2-+H3O+ |
| C、NH3+H+=NH4+ |
| D、HSO3-+OH-=H2O+SO32- |
镁条和铝片为电极,并用导线连接同时插入NaOH溶液中,下列说法正确的是( )
| A、镁条作负极,电极反应:Mg-2e-=Mg2+ |
| B、铝片作负极,电极反应:Al+4OH--3e--=AlO2-+2H2O |
| C、电流从Al电极沿导线流向Mg电极 |
| D、铝片上有气泡产生 |
一定温度下,石灰浆中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是( )
| A、溶液中Ca2+离子数目减少 |
| B、溶液中c(Ca2+)增大 |
| C、溶液的pH增大 |
| D、溶液中溶质的质量分数增大 |
 为探究铁腐蚀的保护方法,某同学按图连接好装 置并往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液.
为探究铁腐蚀的保护方法,某同学按图连接好装 置并往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液.