题目内容
现有有机物A、B、C、D、E能发生如图所示的转化.请回答下面有关问题:

(1)写出A、B、C、D的结构简式: ; ; ;
(2)写出反应⑤的化学方程式:
(3)写出C和D在浓硫酸、加热作用下生成E的化学反应方程式: .

(1)写出A、B、C、D的结构简式:
(2)写出反应⑤的化学方程式:
(3)写出C和D在浓硫酸、加热作用下生成E的化学反应方程式:
考点:有机物的推断
专题:有机物的化学性质及推断
分析:B发生加聚反应生成聚氯乙烯,故B为CH2=CHCl,乙炔与HCl发生取代反应生成B,乙炔与水发生加成反应生成乙醛,乙醛进一步发生氧化反应生成D为CH3COOH,C与D反应生成E,应是酯化反应,则E属于酯,故C属于醇,则乙炔与氢气发生加成反应生成A为CH2=CH2,乙烯与水发生加成反应生成C为CH3CH2OH,乙醇与乙酸发生酯化反应生成E为CH3COOCH2CH3,据此解答.
解答:
解:B发生加聚反应生成聚氯乙烯,故B为CH2=CHCl,乙炔与HCl发生取代反应生成B,乙炔与水发生加成反应生成乙醛,乙醛进一步发生氧化反应生成D为CH3COOH,C与D反应生成E,应是酯化反应,则E属于酯,故C属于醇,则乙炔与氢气发生加成反应生成A为CH2=CH2,乙烯与水发生加成反应生成C为CH3CH2OH,乙醇与乙酸发生酯化反应生成E为CH3COOCH2CH3,
(1)由上述分析可知,A的结构简式为CH2=CH2,B的结构简式为CH2=CHCl,C的结构简式为CH3CH2OH,D的结构简式为CH3COOH,故答案为:CH2=CH2;CH2=CHCl;CH3CH2OH;CH3COOH;
(2)反应⑤是CH2=CHCl发生加聚反应生成聚氯乙烯,反应方程式为:n CH2=CHCl
 ,故答案为:n CH2=CHCl
,故答案为:n CH2=CHCl
 ;
;
(3)应是与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O.
(1)由上述分析可知,A的结构简式为CH2=CH2,B的结构简式为CH2=CHCl,C的结构简式为CH3CH2OH,D的结构简式为CH3COOH,故答案为:CH2=CH2;CH2=CHCl;CH3CH2OH;CH3COOH;
(2)反应⑤是CH2=CHCl发生加聚反应生成聚氯乙烯,反应方程式为:n CH2=CHCl
| 催化剂 |
 ,故答案为:n CH2=CHCl
,故答案为:n CH2=CHCl| 催化剂 |
 ;
;(3)应是与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
点评:本题考查有机物推断,涉及炔、烯烃、醇、醛、羧酸性质与转化,比较基础,注意对有机化学基础的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
铝片与盐酸的反应属于( )
| A、吸热反应 |
| B、放热反应 |
| C、氧化还原反应 |
| D、非氧化还原反应 |
下列方程式书写不正确的是( )
| A、NaHS水解:HS-+H2O?H2S+OH- |
| B、氢氧化钡溶于水电离:Ba(OH)2═Ba2++2OH- |
| C、醋酸溶于水电离:CH3COOH?CH3COO-+H+ |
| D、碳酸钠水解:CO32-+2H2O?2OH-+H2CO3 |
 固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
固体硝酸盐加热易分解且产物较复杂.已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下: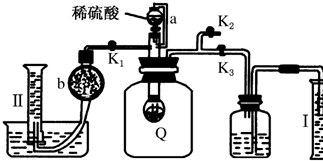 为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中.
为测定保存在干燥环境中已部分变质的过氧化钠样品(只有一种杂质)的纯度,设计了如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,按图安装好仪器,打开漏斗的活塞,将稀硫酸滴入气球中. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下: