题目内容
含有C、H、O三种元素的有机物A、B、C、D,它们的实验式(最简式)相同.
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,3.0g A完全燃烧生成0.1mol CO2和0.1mol H2O.则A的分子式为 ;
(2)有机物B是日常生活中一种调味品的成分.B能和Na2CO3 反应放出气体,在一定条件下能与乙醇反应.写出B与乙醇反应的化学方程式 .
(3)有机物C是一种白色固体有甜味,常用于制镜工业,写出C的分子式 .
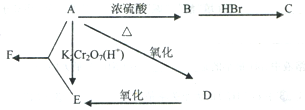
(4)有机物D的相对分子质量是A的3倍,D具有酸性,1mol D与足量Na反应生成22.4L H2 (标准状况),D具有下列转化关系: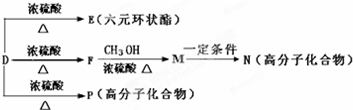
D的结构简式
D→E的化学方程式
M→N的化学方程式 反应类型
D→P的化学方程式 反应类型 .
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,3.0g A完全燃烧生成0.1mol CO2和0.1mol H2O.则A的分子式为
(2)有机物B是日常生活中一种调味品的成分.B能和Na2CO3 反应放出气体,在一定条件下能与乙醇反应.写出B与乙醇反应的化学方程式
(3)有机物C是一种白色固体有甜味,常用于制镜工业,写出C的分子式
(4)有机物D的相对分子质量是A的3倍,D具有酸性,1mol D与足量Na反应生成22.4L H2 (标准状况),D具有下列转化关系:

D的结构简式
D→E的化学方程式
M→N的化学方程式
D→P的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:含有C、H、O三种元素的有机物A、B、C、D,它们的实验式(最简式)相同.
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,则Mr(A)=15×2=30,只能含有1个C原子、1个O原子、2个H原子,则A的分子式为CH2O;
(2)有机物B是日常生活中一种调味品的成分,B能和Na2CO3 反应放出气体,含有羧基,最简式为CH2O,则B为CH3COOH;
(3)有机物C是一种白色固体有甜味,常用于制镜工业,最简式为CH2O,则C为葡萄糖;
(4)有机物D的相对分子质量是A的3倍,则D的分子式为C3H6O3,D具有酸性,含有-COOH,1mol D与足量Na反应生成22.4L H2 (标准状况),氢气为1mol,说明D中还含有1个-OH,D能形成六元环酯,则D的结构简式为 ,E的结构简式为
,E的结构简式为 ,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为
,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为 ,D发生缩聚反应生成高分子化合物P为
,D发生缩聚反应生成高分子化合物P为 ,据此解答.
,据此解答.
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,则Mr(A)=15×2=30,只能含有1个C原子、1个O原子、2个H原子,则A的分子式为CH2O;
(2)有机物B是日常生活中一种调味品的成分,B能和Na2CO3 反应放出气体,含有羧基,最简式为CH2O,则B为CH3COOH;
(3)有机物C是一种白色固体有甜味,常用于制镜工业,最简式为CH2O,则C为葡萄糖;
(4)有机物D的相对分子质量是A的3倍,则D的分子式为C3H6O3,D具有酸性,含有-COOH,1mol D与足量Na反应生成22.4L H2 (标准状况),氢气为1mol,说明D中还含有1个-OH,D能形成六元环酯,则D的结构简式为
 ,E的结构简式为
,E的结构简式为 ,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为
,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为 ,D发生缩聚反应生成高分子化合物P为
,D发生缩聚反应生成高分子化合物P为 ,据此解答.
,据此解答.解答:
解:含有C、H、O三种元素的有机物A、B、C、D,它们的实验式(最简式)相同.
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,则Mr(A)=15×2=30,只能含有1个C原子、1个O原子、2个H原子,则A的分子式为CH2O,故答案为:CH2O;
(2)有机物B是日常生活中一种调味品的成分,B能和Na2CO3 反应放出气体,含有羧基,最简式为CH2O,则B为CH3COOH,与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;
(3)有机物C是一种白色固体有甜味,常用于制镜工业,最简式为CH2O,则C为葡萄糖,分子式为C6H12O6,故答案为:C6H12O6;
(4)有机物D的相对分子质量是A的3倍,则D的分子式为C3H6O3,D具有酸性,含有-COOH,1mol D与足量Na反应生成22.4L H2 (标准状况),氢气为1mol,说明D中还含有1个-OH,D能形成六元环酯,则D的结构简式为 ,E的结构简式为
,E的结构简式为 ,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为
,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为 ,D发生缩聚反应生成高分子化合物P为
,D发生缩聚反应生成高分子化合物P为 ,
,
D→E的化学方程式为:2
 +H2O,
+H2O,
M→N的化学方程式为:n CH2=CHCOOCH3
 ,属于加聚反应;
,属于加聚反应;
D→P的化学方程式为:n
 +(n-1)H2O,属于缩聚反应,
+(n-1)H2O,属于缩聚反应,
故答案为: ;2
;2
 +H2O;
+H2O;
n CH2=CHCOOCH3
 ,加聚反应;
,加聚反应;
n
 +(n-1)H2O,缩聚反应.
+(n-1)H2O,缩聚反应.
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,则Mr(A)=15×2=30,只能含有1个C原子、1个O原子、2个H原子,则A的分子式为CH2O,故答案为:CH2O;
(2)有机物B是日常生活中一种调味品的成分,B能和Na2CO3 反应放出气体,含有羧基,最简式为CH2O,则B为CH3COOH,与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(3)有机物C是一种白色固体有甜味,常用于制镜工业,最简式为CH2O,则C为葡萄糖,分子式为C6H12O6,故答案为:C6H12O6;
(4)有机物D的相对分子质量是A的3倍,则D的分子式为C3H6O3,D具有酸性,含有-COOH,1mol D与足量Na反应生成22.4L H2 (标准状况),氢气为1mol,说明D中还含有1个-OH,D能形成六元环酯,则D的结构简式为
 ,E的结构简式为
,E的结构简式为 ,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为
,D发生消去反应生成F为CH2=CHCOOH,F与甲醇发生酯化反应生成M为CH2=CHCOOCH3,M发生加聚反应生成N为 ,D发生缩聚反应生成高分子化合物P为
,D发生缩聚反应生成高分子化合物P为 ,
,D→E的化学方程式为:2

| 浓硫酸 |
| △ |
 +H2O,
+H2O,M→N的化学方程式为:n CH2=CHCOOCH3
| 催化剂 |
 ,属于加聚反应;
,属于加聚反应;D→P的化学方程式为:n

| 催化剂 |
 +(n-1)H2O,属于缩聚反应,
+(n-1)H2O,属于缩聚反应,故答案为:
 ;2
;2
| 浓硫酸 |
| △ |
 +H2O;
+H2O;n CH2=CHCOOCH3
| 催化剂 |
 ,加聚反应;
,加聚反应;n

| 催化剂 |
 +(n-1)H2O,缩聚反应.
+(n-1)H2O,缩聚反应.
点评:本题考查有机物推断,注意相对分子质量确定A的分子式,结合相对分子质量判断D的组成,根据D发生的反应判断含有的官能团,再结合转化关系推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
恒温恒压,不做功时,反应A+B═C+D,在下列哪种情况下,一定能自发进行( )
| A、△H<0,△S>0 |
| B、△H>0,△S>0 |
| C、△H<0,△S<0 |
| D、△H>0,△S<0 |
某温度下,向容积为20L的密闭反应器中充入0.2molHI(g),达到平衡后测得HI的转化率为80%,则该温度下反应H2(g)+I2(g)?2HI(g)的平衡常数是( )
| A、2.5×10-2 |
| B、0.25 |
| C、4.0 |
| D、4.0×102 |
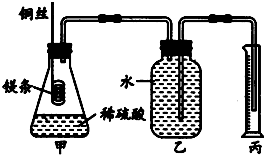 化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).
化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).