题目内容
一定温度下,石灰浆中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是( )
| A、溶液中Ca2+离子数目减少 |
| B、溶液中c(Ca2+)增大 |
| C、溶液的pH增大 |
| D、溶液中溶质的质量分数增大 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:一定温度下,向石灰乳浊液中加入少量生石灰,CaO和水发生反应CaO+H2O=Ca(OH)2,水参加反应导致溶剂的量减少,溶质的量增大,溶液成为过饱和溶液,有部分Ca(OH)2(s)析出,但溶液浓度不变,以此解答该题.
解答:
解:一定温度下,向石灰乳浊液中加入少量生石灰,CaO和水发生反应CaO+H2O=Ca(OH)2,水参加反应导致溶剂的量减少,溶质的量增大,溶液成为过饱和溶液,有部分Ca(OH)2(s)析出,但因温度不变,则溶解度不变,仍未饱和溶液,则溶液中c(Ca2+)、c(OH-)都不变,溶液体积减小,则溶液中n(Ca2+)减小,溶液pH不变,质量分数不变,
故选A.
故选A.
点评:本题主要考查的是难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度不大,要注意向石灰浆中加少量生石灰,发生的反应:CaO+H2O=Ca(OH)2,从平衡移动的角度分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
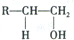
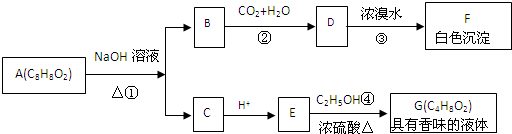
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下: