题目内容
某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(1)配制待测液
(2)滴定
①用 量取10.00mL待测液.
②向锥形瓶中加入几滴酚酞,用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视 直到 时停止滴定.
(3)数据处理
(4)下列操作,会导致实验结果偏低的是 (填序号).
①碱式滴定管用蒸馏水洗净后没有待测液润洗
②终点读数时俯视(滴定前读数标准)
③锥形瓶用蒸馏水洗净后没有待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有待测液润洗
⑥震荡时锥形瓶中液滴飞溅出来.
(1)配制待测液
(2)滴定
①用
②向锥形瓶中加入几滴酚酞,用0.2010mol?L-1标准盐酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视
(3)数据处理
(4)下列操作,会导致实验结果偏低的是
①碱式滴定管用蒸馏水洗净后没有待测液润洗
②终点读数时俯视(滴定前读数标准)
③锥形瓶用蒸馏水洗净后没有待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有待测液润洗
⑥震荡时锥形瓶中液滴飞溅出来.
考点:中和滴定
专题:实验探究和数据处理题
分析:(2)①根据碱性溶液盛放在碱式滴定管中;
②根据滴定时,两眼注视锥形瓶中溶液颜色的变化;溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据实验操作对c(待测)=
的影响分析产生的误差.
②根据滴定时,两眼注视锥形瓶中溶液颜色的变化;溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据实验操作对c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(2)①待测液是碱性溶液,应盛放在碱式滴定管中,通过滴定管量取10.00mL待测液,
故答案为:碱式滴定管;
②滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色,表明达到滴定终点;
故答案为:锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不褪色;
(4)①碱式滴管用蒸馏水洗净后没有用待测液润洗,待测液被稀释,造成V(标准)偏小,根据c(待测)=
分析,可知C(待测)偏小,故①正确;
②终点读数时俯视(滴定前读数准确),造成V(标准)偏小,根据c(待测)=
分析,可知C(待测)偏小,故②正确;
③锥形瓶用蒸馏水洗净后没有用待测液润洗,对V(标准)无影响,根据c(待测)=
分析,可知C(待测)无影响,故③错误;
④酸式滴定管尖端气泡没有排除,滴定后消失,造成V(标准)偏大,根据c(待测)=
分析,可知C(待测)偏大,故④错误;
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
分析,可知C(待测)偏大,故⑤错误;
⑥振荡时锥形瓶中液滴飞溅出来,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=
分析,可知C(待测)偏小,故⑥正确;
故答案为:①②⑥.
故答案为:碱式滴定管;
②滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;滴定时,当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色,表明达到滴定终点;
故答案为:锥形瓶中溶液颜色的变化;溶液由红色变为无色,且半分钟内不褪色;
(4)①碱式滴管用蒸馏水洗净后没有用待测液润洗,待测液被稀释,造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
②终点读数时俯视(滴定前读数准确),造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
③锥形瓶用蒸馏水洗净后没有用待测液润洗,对V(标准)无影响,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
④酸式滴定管尖端气泡没有排除,滴定后消失,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
⑥振荡时锥形瓶中液滴飞溅出来,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:①②⑥.
点评:本题主要考查了中和滴定操作、误差分析,难度中等,注意分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )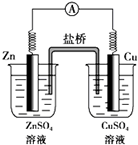

| A、反应中,盐桥中的Cl-会移向ZnSO4溶液 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、铜片上有气泡逸出 |
| D、锌为负极,发生还原反应,电极反应式为:Zn-2e-=Zn2+ |
某温度下,向容积为20L的密闭反应器中充入0.2molHI(g),达到平衡后测得HI的转化率为80%,则该温度下反应H2(g)+I2(g)?2HI(g)的平衡常数是( )
| A、2.5×10-2 |
| B、0.25 |
| C、4.0 |
| D、4.0×102 |