题目内容
18.(1)乙醇是未来内燃机的首选环保型液体燃料.2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.89kJ•mol-1.(2)在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3kJ热量,写出热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.
分析 (1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,乙醇完全燃烧生成二氧化碳和液态水,依据2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,计算1mol乙醇燃烧完全燃烧生成液态水放出的热量,据此书写乙醇燃烧热的热化学方程式;
(2)先写出甲烷燃烧的方程式,注明反应物、生成物的聚集状态,依据1molCH4完全燃烧生成CO2和液态H2O,放出890.3kJ热量判断反应焓变,书写热化学方程式.
解答 解:(1)乙醇完全燃烧生成二氧化碳和液态水,依据2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,
则1mol乙醇完全燃烧生成液态水放出的热量为:1366.89KJ,所以燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.89kJ•mol-1;
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.89kJ•mol-1;
(2)在101kPa时,1molCH4完全燃烧生成CO2和液态H2O,放出890.3kJ热量,反应的热化学方程式:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3kJ•mol-1;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3kJ•mol-1.
点评 本题考查了热化学方程式的书写,书写热化学方程式应注意注明反应物聚集状态,注意焓变值与方程式系数关系,注意燃烧热中可燃物物质的量为1mol,生成物为稳定的氧化物,题目难度不大.

练习册系列答案
相关题目
3.关于氯化镁溶液和氢氧化铁胶体的说法中正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
4.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 恰好完全反应时,溶液不易导电,所以BaSO4和水都是非电解质 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
13.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2(g)$\stackrel{高温}{?}$ W (s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c^3({H}_{2}O)}{c^3({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)?W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2?W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2(s)?WO2 (g) 的△H=+203.9kJ•mol-1.
3.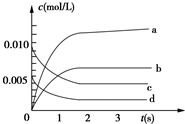 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3 mol/(L•s).
(3)能说明该反应已达到平衡状态的是b、c.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3 mol/(L•s).
(3)能说明该反应已达到平衡状态的是b、c.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
10.石灰乳中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH- (aq),加入下列溶液,可使Ca(OH)2减少的是( )
| A. | Na2S溶液 | B. | AlCl3溶液 | C. | NaOH溶液 | D. | CaCl2溶液 |
7.下列说法错误的是( )
| A. | 油脂在碱性条件下水解得到高级脂肪酸和甘油 | |
| B. | 乙酸和乙酸乙酯中都存在碳氧双键 | |
| C. | 酯化反应和酯的水解反应互为可逆反应 | |
| D. | 乙酸乙酯和油脂完全燃烧都只生成CO2和H2O |
8.下列物质属于电解质的是( )
| A. | CO2 | B. | C12H22O11(蔗糖) | C. | BaSO4 | D. | NaOH溶液 |