题目内容
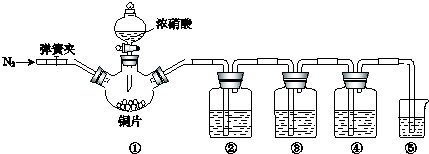
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.344L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入 6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
考点:化学方程式的有关计算,硝酸的化学性质
专题:
分析:根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,再根据Cu(NO3)2~2NaOH,Cu(NO3)2与NaOH 反应的关系,求出NaOH 的物质的量,最终求出NaOH溶液的体积.
解答:
解:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了
Cu失去电子等于氧气得到电子,根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2=
mol×4
解得:n(Cu)=0.12mol
所以 Cu(NO3)2 为0.12mol
由Cu~Cu(NO3)2~2NaOH可知,Cu2+~2OH-
0.12mol n(OH-)
则NaOH 为 0.12mol×2=0.24 mol
则NaOH 体积V=
=
=0.04L,即 40 ml,
故选B.
Cu失去电子等于氧气得到电子,根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2=
| 1.344L |
| 22.4L/mol |
解得:n(Cu)=0.12mol
所以 Cu(NO3)2 为0.12mol
由Cu~Cu(NO3)2~2NaOH可知,Cu2+~2OH-
0.12mol n(OH-)
则NaOH 为 0.12mol×2=0.24 mol
则NaOH 体积V=
| n |
| c |
| 0.24mol |
| 6mol/L |
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒、原子守恒的计算为解答的关键,侧重分析能力与计算能力的综合考查,题目难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
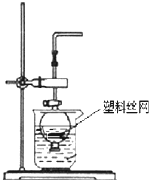 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
下列离子方程式中,错误的是( )
| A、氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| B、氯气与KOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| C、盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ |
| D、NaCl溶液与AgNO3溶液反应:Cl-+Ag+=AgCl↓ |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物时,X可以显负价,Y显正价 |
| B、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |