题目内容
下列离子方程式中,错误的是( )
| A、氯气与烧碱溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| B、氯气与KOH溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
| C、盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ |
| D、NaCl溶液与AgNO3溶液反应:Cl-+Ag+=AgCl↓ |
考点:离子方程式的书写
专题:
分析:A.氯气能够与强碱溶液反应生成氯离子、次氯酸根离子和水;
B.氯气与氢氧化钾溶液反应生成氯化钾、次氯酸钾和水;
C.盐酸中的氯化氢在离子方程式中需要拆开,不能保留分子式;
D.氯化钠与硝酸银反应生成氯化银沉淀和可溶性的硝酸钠.
B.氯气与氢氧化钾溶液反应生成氯化钾、次氯酸钾和水;
C.盐酸中的氯化氢在离子方程式中需要拆开,不能保留分子式;
D.氯化钠与硝酸银反应生成氯化银沉淀和可溶性的硝酸钠.
解答:
解:A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.氯气与KOH溶液反应生成氯化钾、次氯酸钾和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.盐酸与AgNO3溶液反应生成氯化银沉淀,氯化氢需要拆开,正确的离子方程式为:Cl-+Ag+=AgCl↓,故C错误;
D.氯化钠溶液与AgNO3溶液反应氯化钠和硝酸钠,反应的离子方程式为:Cl-+Ag+=AgCl↓,故D正确;
故选C.
B.氯气与KOH溶液反应生成氯化钾、次氯酸钾和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.盐酸与AgNO3溶液反应生成氯化银沉淀,氯化氢需要拆开,正确的离子方程式为:Cl-+Ag+=AgCl↓,故C错误;
D.氯化钠溶液与AgNO3溶液反应氯化钠和硝酸钠,反应的离子方程式为:Cl-+Ag+=AgCl↓,故D正确;
故选C.
点评:本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
在下列反应中,水既不作氧化剂又不作还原剂的氧化还原反应是( )
| A、2Na+2H2O═2NaOH+H2↑ | ||||
B、C+H2O(g)
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
| D、Cl2+H2O═HCl+HClO |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.344L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入 6mol?L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60 mL |
| B、40mL |
| C、30 mL |
| D、15 mL |
根据下列三个反应,判断下列物质的氧化性由强到弱的顺序是( )
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
①2Fe3++2I-=2Fe2++I2
②2Fe2++C12=2Fe3++2C1-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
| A、Fe3+>C12>MnO4- |
| B、Fe3+>Cl2>I2 |
| C、I2>Cl2>Fe3+ |
| D、MnO4->Cl2>Fe3+ |
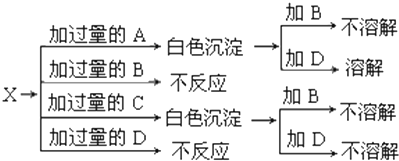 如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
如图中A、B、C、D分别是KNO3、KOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.